Magnesiumsulfat
Autoren: Amelie Stahlbuhk
zurück zu Sulfate
| Dieser Artikel wird gerade neu erstellt und ist noch nicht vollständig. |
Absract[Bearbeiten]
Die verschiedenen Hydratformen des Magnesiumsulfats sollen vorgestellt werden, sowie ihr Verhalten bezüglich Löslichkeit und Hygroskopizität.
Hydratformen[Bearbeiten]
Es gibt mehrere Hydratformen des Magnesiumsulfats, wobei wasserfreies Magnesiumsulfat nicht in der Natur vorkommt.
Kieserit MgSO4•H2O
Sanderit MgSO4•2H2O
Starkeyit MgSO4•4H2O
Pentahydrit MgSO4•5H2O
Hexahydrit MgSO4•6H2O
Epsomit MgSO4•7H2O
Meridianiit MgSO4•11H2O
Lösungsverhalten[Bearbeiten]
Die Magnesiumsulfathydratformen gehören zu den leichtlöslichen Salzen (s. Tabelle). Mit der hohen Löslichkeit ist auch eine hohe Mobilität in porösen Materialien verbunden.
| Hydratform | Löslichkeit [mol/kg] bei 20°C |
| Kieserit | 5,60 |
| Starkeyit | 5,04 |
| Pentahydrit | 4,40 |
| Hexahydrit | 3,61 |
| Epsomit | 2,84 |
Das Löslichkeitsdiagramm des MgSO4-H2O-Systems enthält aufgrund der verschiedenen Hydratstufen, mit sowohl stabilen als auch mit metastabilen Gleichgewichten, mehr Inhalte als jene von Salzen mit weniger oder keinen Hydratstufen. Die Temperaturabhängigkeit der Löslichkeit führt dazu, dass mit Temperaturänderungen gegebenenfalls die Hydratation oder die Dehydratation einer betrachteten Phase einhergeht.
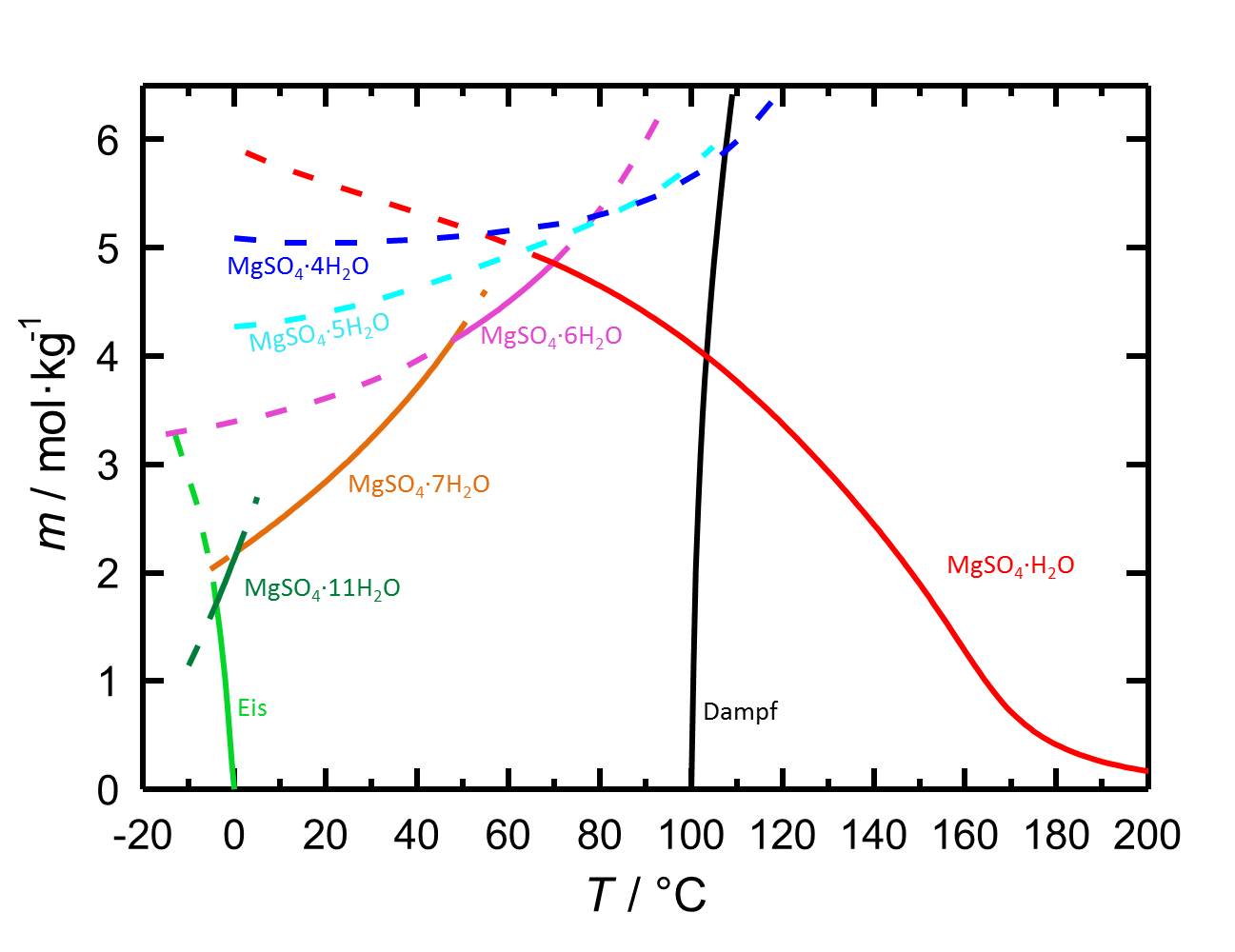
Autor / Verfasser: Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M.
 .
.
Hygroskopizität[Bearbeiten]
Je nach Temperatur oder relativer Luftfeuchte kann es bei Änderungen dieser Variablen im System MgSO4-H2O zur Hydratation oder zur Dehydratation beziehungsweise zur Deliqueszenz oder Kristallisation kommen. Bei einer Temperatur von 20 °C ist Epsomit unterhalb seiner Deliqueszenzfeuchte von 91,3 % die vorliegende kristalline Phase. Ab einer relativen Luftfeuchte von etwa 47 % kommt es zur Dehydratation des Salzes zu nierdrigeren Hydratstufen, wie es die Kurven der Gleichgewichtskurven in Abbildung 2 zeigen.
| Betrachtete Phasenübergänge | Deliqueszenz-/Gleichgewichtsfeuchte bei 20°C |
| Epsomit-Lösung | 91,3 % |
| Epsomit-Hexahydrit | 46,6 % |
| Epsomit-Kieserit | 46,7 % |
| Hexahydrit-Starkeyit | 39,1 % |
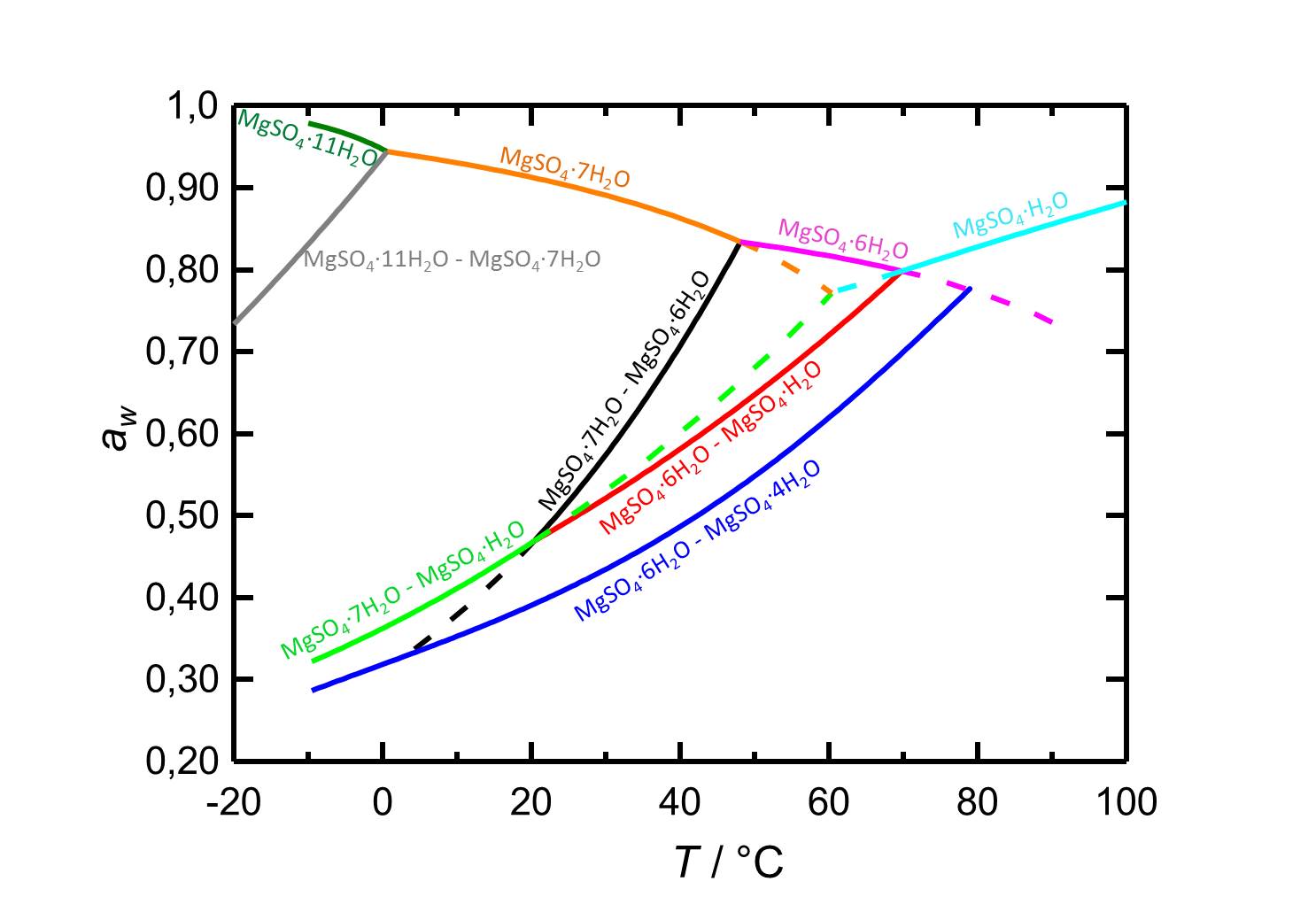
Autor / Verfasser: Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M.
 .
.
Im Temperaturbereich von -10 bis 100 °C liegen die Deliqueszenzfeuchten der je nach Temperatur vorliegenden Hydratstufen stets oberhalb von 80 % r.F., so dass sie eine geringe Hygroskopizität aufweisen.
Weblinks[Bearbeiten]
Literatur[Bearbeiten]
| [Mainusch:2001] | Mainusch, Nils (2001): Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung, Diplomarbeit, HAWK Hochschule für angewandte Wissenschaft und Kunst Hildesheim/Holzminden/Göttingen, file:Diplomarbeit Nils Mainusch.pdf |   |
| [Stark.etal:1996] | Stark, Jochen; Stürmer, Sylvia (1996): Bauschädliche Salze, Bauhaus-Univ. Weimar |  |
| [Steiger.etal:2011a] | Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M. (2011): Decomposition reactions of magnesium sulfate hydrates and phase equilibria in the MgSO4-H2O and Na+-Mg2+-Cl--SO42--H2O systems with implications for Mars. In: Geochimica et Cosmochimica Act, 75 (12), 3600-3626, https://doi.org/10.1016/j.gca.2011.03.038 |  |