Deliqueszenzfeuchte: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (3 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autor: [[user:MSteiger|Michael Steiger]] | Autor: [[user:MSteiger|Michael Steiger]] | ||
<br> | <br> | ||
| Zeile 15: | Zeile 13: | ||
In Baustoffen liegt eine andere Situation vor, denn Salze bzw. Salzlösung stehen hier nicht mehr nur mit einem begrenzten Luftvolumen in Kontakt. In der freien Atmosphäre mit ihrem riesigen Reservoir an Wasserdampf kontrolliert die relative Luftfeuchtigkeit den Zustand einer begrenzten Salzmenge im Porenraum eines Baustoffs. Hier ist die DRH eine extrem wichtige Größe, da Schwankungen der relativen Luftfeuchtigkeit um die DRH ständig zu Kristallisation und Wiederauflösung von Salzen führen. Dabei handelt es sich um einen der wichtigsten [[Schadensprozesse]] in Baustoffen.<br><br> | In Baustoffen liegt eine andere Situation vor, denn Salze bzw. Salzlösung stehen hier nicht mehr nur mit einem begrenzten Luftvolumen in Kontakt. In der freien Atmosphäre mit ihrem riesigen Reservoir an Wasserdampf kontrolliert die relative Luftfeuchtigkeit den Zustand einer begrenzten Salzmenge im Porenraum eines Baustoffs. Hier ist die DRH eine extrem wichtige Größe, da Schwankungen der relativen Luftfeuchtigkeit um die DRH ständig zu Kristallisation und Wiederauflösung von Salzen führen. Dabei handelt es sich um einen der wichtigsten [[Schadensprozesse]] in Baustoffen.<br><br> | ||
== Deliqueszenzfeuchten einiger Salze == | == Deliqueszenzfeuchten einiger Salze == | ||
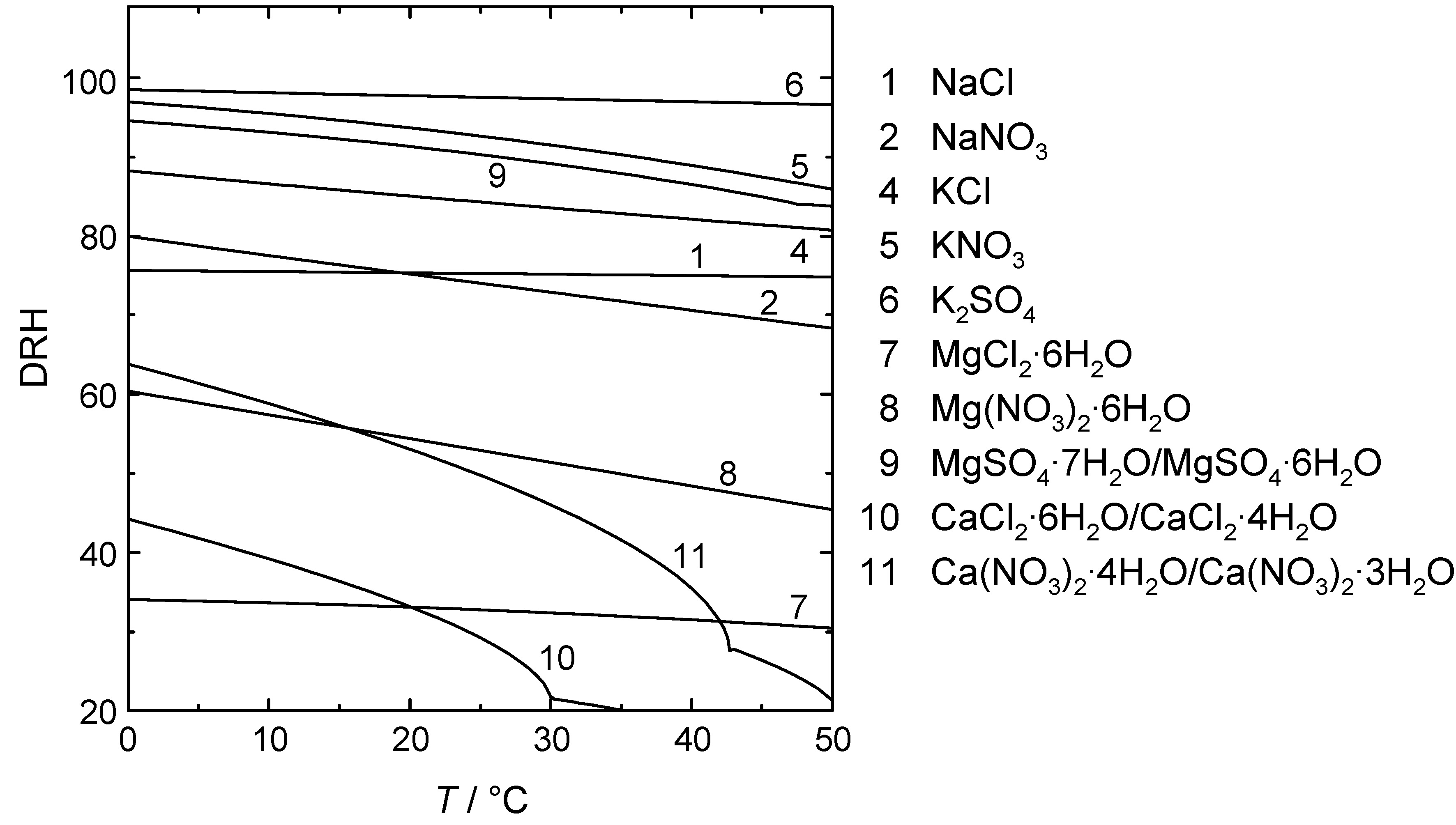
Die Deliqueszenzfeuchtigkeiten verschiedener bauschädlicher Salze sind sehr unterschiedlich und hängen qualitativ mit der Salzlöslichkeit zusammen. Mit steigender Löslichkeit nimmt die Deliqueszenzfeuchtigkeit stark ab. Beispielsweise besitzen die sehr gut löslichen Calcium- und Magnesiumchloride DRH von nur ca. 30% und das im Labor häufig verwendete Lithiumchlorid besitzt eine Deliqueszenzfeuchtigkeit von nur ca. 11%. Umgekehrt weist Gips (CaSO<sub>4</sub>•2H<sub>2</sub>O) auf Grund seiner ausgesprochen geringen Wasserlöslichkeit eine DRH von <nowiki>></nowiki>99.9% auf. Daraus ist zu folgern, dass Magnesium- und Calciumchloride (MgCl<sub>2</sub>•6H<sub>2</sub>O, CaCl<sub>2</sub>•6H<sub>2</sub>O) in Baustoffen üblicherweise nie auskristallisieren, während Gips praktisch immer kristallin vorliegt. Auf Grund der Temperaturabhängigkeit der Löslichkeit vieler Salze weisen auch die DRH häufig eine starke Temperaturabhängigkeit auf. In nebenstehender Abbildung sind DRH einiger bauschädlicher Salze in Abhängigkeit von der Temperatur dargestellt. Nachstehende Tabelle listet für einige Salze Zahlenwerte bei runden Temperaturen auf.<br><br> | Die Deliqueszenzfeuchtigkeiten verschiedener bauschädlicher Salze sind sehr unterschiedlich und hängen qualitativ mit der Salzlöslichkeit zusammen. Mit steigender Löslichkeit nimmt die Deliqueszenzfeuchtigkeit stark ab. Beispielsweise besitzen die sehr gut löslichen Calcium- und Magnesiumchloride DRH von nur ca. 30% und das im Labor häufig verwendete Lithiumchlorid besitzt eine Deliqueszenzfeuchtigkeit von nur ca. 11%. Umgekehrt weist Gips (CaSO<sub>4</sub>•2H<sub>2</sub>O) auf Grund seiner ausgesprochen geringen Wasserlöslichkeit eine DRH von <nowiki>></nowiki>99.9% auf. Daraus ist zu folgern, dass Magnesium- und Calciumchloride (MgCl<sub>2</sub>•6H<sub>2</sub>O, CaCl<sub>2</sub>•6H<sub>2</sub>O) in Baustoffen üblicherweise nie auskristallisieren, während Gips praktisch immer kristallin vorliegt. Auf Grund der Temperaturabhängigkeit der Löslichkeit vieler Salze weisen auch die DRH häufig eine starke Temperaturabhängigkeit auf. In nebenstehender Abbildung sind DRH einiger bauschädlicher Salze in Abhängigkeit von der Temperatur dargestellt. Nachstehende Tabelle listet für einige Salze Zahlenwerte bei runden Temperaturen auf.<br><br> | ||
| Zeile 141: | Zeile 137: | ||
[[Category:Deliqueszenzfeuchte]] [[Category: | [[Category:Deliqueszenzfeuchte]] [[Category:Steiger,Michael]] [[Category:R-MSteiger]] [[Category:Review]] | ||
Aktuelle Version vom 2. Juli 2012, 16:42 Uhr
Autor: Michael Steiger
zurück zu SalzWiki:Portal
Deliqueszenz[Bearbeiten]
Wird ein Kristall eines reinen Salzes, das keinen Hydratationsprozessen unterliegt, einer steigender relativen Luftfeuchtigkeit ausgesetzt, so nimmt er ab einer für dieses Salz charakteristischen Luftfeuchtigkeit, der Deliqueszenzfeuchtigkeit (DRH), Wasserdampf auf und bildet eine Lösung. Bei weiterer Erhöhung der Luftfeuchtigkeit wird mehr Wasser aufgenommen und die Lösung verdünnt sich stark. Die Deliqueszenzfeuchtigkeit beschreibt also das Phasengleichgewicht zwischen einem Salz in festem, kristallinem Zustand und einer Salzlösung, gleichzeitig auch das Gleichgewicht zwischen flüssigem Wasser und Wasserdampf.
Bei relativen Luftfeuchtigkeiten unterhalb der DRH kann eine Lösung des betreffenden Salzes nicht existieren. Das bedeutet, dass eine Salzlösung, die einer relativen Luftfeuchtigkeit unterhalb der DRH ausgesetzt wird, das Wasser durch Verdunstung vollständig abgibt, die Lösung trocknet ein. Umgekehrt kann oberhalb seiner DRH ein Salz in kristalliner Form nicht existieren und es bildet sich durch Aufnahme von Wasser aus der umgebenden Luft eine Salzlösung. Mit steigender relativer Luftfeuchtigkeit nimmt die Salzlösung immer mehr Wasser auf, d.h. die Lösung verdünnt sich. Der Zusammenhang zwischen relativer Luftfeuchtigkeit und hygroskopischer Wasseraufnahme einer Salzlösung ist durch die Wasseraktivität gegeben.
Genau bei der DRH besteht Gleichgewicht zwischen dem kristallinen Salz, seiner gesättigten Lösung und dem Wasserdampfgehalt der umgebenden Luft, ausgedrückt durch die relative Luftfeuchtigkeit. Aus diesem Grund wird die Deliqueszenzfeuchtigkeit häufig auch als Sättigungsfeuchtigkeit bezeichnet. Dieses Gleichgewicht ist die Grundlage für die Verwendung gesättigter Salzlösungen zur Einstellungen definierter relativer Luftfeuchtigkeiten in einem abgeschlossenen Luftvolumen, beispielsweise in Vitrinen oder in Klimaschränken im Labor. Wird durch andere Einflüsse die Luftfeuchtigkeit in einem Luftvolumen erhöht, so kann die überschüssige Feuchtigkeit von der gesättigten Lösung aufgenommen werden. Dies hat eine Verdünnung der Lösung zur Folge, was durch eine teilweise Auflösung des Bodenkörpers ausgeglichen wird, bis die Lösung wieder gesättigt und sich im Gleichgewicht mit der umgebenden Luft befindet. Wird umgekehrt die Luftfeuchtigkeit abgesenkt, kommt es zur Verdunstung von, die durch Auskristallisation des Salzes, also Bildung von neuem Bodenkörper ausgeglichen wird. In beiden Fällen wirkt die gesättigte Salzlösung also der Veränderung der Luftfeuchtigkeit entgegen und hält diese konstant auf dem Wert der DRH.
In Baustoffen liegt eine andere Situation vor, denn Salze bzw. Salzlösung stehen hier nicht mehr nur mit einem begrenzten Luftvolumen in Kontakt. In der freien Atmosphäre mit ihrem riesigen Reservoir an Wasserdampf kontrolliert die relative Luftfeuchtigkeit den Zustand einer begrenzten Salzmenge im Porenraum eines Baustoffs. Hier ist die DRH eine extrem wichtige Größe, da Schwankungen der relativen Luftfeuchtigkeit um die DRH ständig zu Kristallisation und Wiederauflösung von Salzen führen. Dabei handelt es sich um einen der wichtigsten Schadensprozesse in Baustoffen.
Deliqueszenzfeuchten einiger Salze[Bearbeiten]
Die Deliqueszenzfeuchtigkeiten verschiedener bauschädlicher Salze sind sehr unterschiedlich und hängen qualitativ mit der Salzlöslichkeit zusammen. Mit steigender Löslichkeit nimmt die Deliqueszenzfeuchtigkeit stark ab. Beispielsweise besitzen die sehr gut löslichen Calcium- und Magnesiumchloride DRH von nur ca. 30% und das im Labor häufig verwendete Lithiumchlorid besitzt eine Deliqueszenzfeuchtigkeit von nur ca. 11%. Umgekehrt weist Gips (CaSO4•2H2O) auf Grund seiner ausgesprochen geringen Wasserlöslichkeit eine DRH von >99.9% auf. Daraus ist zu folgern, dass Magnesium- und Calciumchloride (MgCl2•6H2O, CaCl2•6H2O) in Baustoffen üblicherweise nie auskristallisieren, während Gips praktisch immer kristallin vorliegt. Auf Grund der Temperaturabhängigkeit der Löslichkeit vieler Salze weisen auch die DRH häufig eine starke Temperaturabhängigkeit auf. In nebenstehender Abbildung sind DRH einiger bauschädlicher Salze in Abhängigkeit von der Temperatur dargestellt. Nachstehende Tabelle listet für einige Salze Zahlenwerte bei runden Temperaturen auf.
| Salz | 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C |
| NaCl | 75.9 | 75.6 | 75.4 | 75.2 | 75.0 | 74.8 |
| NaNO3 | 80.1 | 77.7 | 75.3 | 72.8 | 70.4 | 68.0 |
| Na2SO4 | 98.8(1) | 97.8(1) | 95.6(1) | 90.1(1) | 87.9 | 88.4 |
| KCl | 88.3 | 86.7 | 85.0 | 83.5 | 82.1 | 80.7 |
| KNO3 | 97.0 | 95.5 | 93.7 | 91.5 | 88.9 | 85.9 |
| MgCl2•6H2O | 34.1 | 33.7 | 33.1 | 32.4 | 31.5 | 30.5 |
| Mg(NO3)2•6H2O | 61.3 | 58.6 | 55.7 | 52.5 | 49.2 | 45.7 |
| MgSO4•7H2O | 94.5 | 93.1 | 91.3 | 89.1 | 86.3 | 83.2(2) |
| CaCl2•6H2O | 44.3 | 39.4 | 33.3 | 21.6(3) | 18.4(3) | 16.3(4) |
| Ca(NO3)2•4H2O | 63.8 | 58.8 | 53.1 | 46.0 | 35.5 | 21.3(5) |
| (1) Na2SO4•10H2O, (2) MgSO4•6H2O, (3)CaCl2•4H2O, (4) CaCl2•2H2O, (5) Ca(NO3)2•3H2O | ||||||
Übersicht über die Deliqueszenzfeuchte der Salze[Bearbeiten]
Extension:DynamicPageList3 (DPL3), version 3.5.2: Fehler: Zu viele Kategorien! Maximum: 4. Hilfe: erhöhe $wgDplSettings['maxCategoryCount'] um weitere Kategorien anzugeben oder setze $wgDplSettings['allowUnlimitedCategories'] = true; für keine Limitierung. (Setze die Variable in der Wiki-Konfigurationsdatei LocalSettings.php.)