Thenardit: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 169: | Zeile 169: | ||
{| cellspacing="1" cellpadding="1" border="1" style="width: 363px; height: 216px;" | {| cellspacing="1" cellpadding="1" border="1" style="width: 363px; height: 216px;" | ||
|- | |- | ||
| rel. Feuchte % | | rel. Feuchte % | ||
| 20,0 °C | | 20,0 °C | ||
| 25,0 °C | | 25,0 °C | ||
| 30,0 °C | | 30,0 °C | ||
|- | |- | ||
| 100 | | 100 | ||
| 48,9 N/mm<sup>2</sup> | | 48,9 N/mm<sup>2</sup> | ||
| 40,5 N/mm<sup>2</sup> | | 40,5 N/mm<sup>2</sup> | ||
| 28,9 N/mm<sup>2</sup> | | 28,9 N/mm<sup>2</sup> | ||
|- | |- | ||
| 95,0 | | 95,0 | ||
| 41,3 N/mm<sup>2</sup> | | 41,3 N/mm<sup>2</sup> | ||
| 32,7 N/mm<sup>2</sup> | | 32,7 N/mm<sup>2</sup> | ||
| 23,3 N/mm<sup>2</sup> | | 23,3 N/mm<sup>2</sup> | ||
|- | |- | ||
| 90,0 | | 90,0 | ||
| 33,5 N/mm<sup>2</sup> | | 33,5 N/mm<sup>2</sup> | ||
| 24,9 N/mm<sup>2</sup> | | 24,9 N/mm<sup>2</sup> | ||
| 13,7 N/mm<sup>2</sup> | | 13,7 N/mm<sup>2</sup> | ||
|- | |- | ||
| 85,0 | | 85,0 | ||
| 25,5 N/mm<sup>2</sup> | | 25,5 N/mm<sup>2</sup> | ||
| 16,0 N/mm<sup>2</sup> | | 16,0 N/mm<sup>2</sup> | ||
| 5,1 N/mm<sup>2</sup> | | 5,1 N/mm<sup>2</sup> | ||
|- | |- | ||
| 80,0 | | 80,0 | ||
| 16,4 N/mm<sup>2</sup> | | 16,4 N/mm<sup>2</sup> | ||
| 7,8 N/mm<sup>2</sup> | | 7,8 N/mm<sup>2</sup> | ||
| 0,0 | | 0,0 | ||
|- | |- | ||
| 75,0 | | 75,0 | ||
| 6,7 N/mm<sup>2</sup> | | 6,7 N/mm<sup>2</sup> | ||
| 0,0 | | 0,0 | ||
| - | | - | ||
|} | |} | ||
''Tabelle 3 – Hydratationsdruck Thenardit-Mirabilit [nach Winkler/Wilhelm 1970] Die Volumenveränderung, die beim Phasenübergang stattfindet ist mit ca. 320% anzugeben [nach Sperling/Cooke 1980]. | ''Tabelle 3 – Hydratationsdruck Thenardit-Mirabilit [nach Winkler/Wilhelm 1970] '' | ||
Die Volumenveränderung, die beim Phasenübergang stattfindet, ist mit ca. 320% anzugeben [nach Sperling/Cooke 1980]. | |||
== Umwandlungsreaktionen == | == Umwandlungsreaktionen == | ||
Version vom 19. September 2009, 12:16 Uhr
| Thenardit | |
| [[Image:{{{bild}}}|300px]] | |
| Mineralogische Salzbezeichnung | Thenardit |
| Chemische Bezeichnung | Natriumsulfat |
| Trivialname | Makit, Menardit, Pyrotechnit |
| Chemische Formel | Na2SO4 |
| Hydratformen |
Mirabilit (Na2SO4 • 10H2O), Natriumsulfatheptahydrat (Na2SO4 • 7H2O) |
| Kristallklasse | orthorhombisch |
| Deliqueszenzfeuchte 20°C | - |
| Dichte (g/cm³) | 2,7 |
| Molvolumen | 53,11cm3/mol |
| Molgewicht | 142,04g/mol |
| Transparenz | |
| Spaltbarkeit | |
| Kristallhabitus | |
| Zwillingsbildung | |
| Brechungsindices | nx = 1,468; ny = 1,473; nz = 1,483 |
| Doppelbrechung | Δ = 0,015 |
| Optische Orientierung | |
| Pleochroismus | |
| Dispersion | |
| Phasenübergang | - |
| Chemisches Verhalten | |
| Bemerkungen | in wasserfreiem Ethanol unlöslich, löslich in Glycerin |
Autoren: Hans-Jürgen Schwarz , Nils Mainusch, NN....
Abstract[Bearbeiten]
Einleitung[Bearbeiten]
Allgemeines[Bearbeiten]
Vorkommen von Thenardit
[Bearbeiten]
Sowohl Thenardit wie auch Mirabilit erscheinen als natürliche Mineralien. In Mineralwässern, als Ablagerungen ehemaliger Salzseen und in Form unterschiedlicher Doppelsalze tritt Natriumsulfat in der Natur auf. Die Kenntnis des kristallwasserhaltigen Natriumsulfates reicht nachweislich bis in das 16. Jh. zurück. Erste Beschreibungen desselben sind von Glauber aus dem Jahre 1658 überliefert, welcher es als “sal mirable” bezeichnete. Auf dessen Namen zurückgehend ist auch
die Trivialbezeichnung “Glaubersalz” für Mirabilit in der Literatur anzutreffen.
Angaben zu Herkunft und Bildung von Thenardit an Baudenkmalen
[Bearbeiten]
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumsulfat als Ausblühsalz entstehen, wenn mit schwefeligen Gasen kontaminierte Luft einwirkt oder sonstige Sulfatquellen vorliegen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch können 100 kg Portlandzement mit einem Gehalt von lediglich 0,1% löslichem Na2O in schwefelsäurehaltiger Luft 520g Mirabilit ausbilden [Angaben nach Arnold/Zehnder 1991]. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendeten Restaurierungsprodukten (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächenwasser anzuführen, die Na+-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem Natriumchlorid. In Küstennähe ist NaCl-haltiges Meerwasser als Natriumquelle zu berücksichtigen.
Angaben zum Schadenspotential und zur Verwitterungsaktivität von Thenardit[Bearbeiten]
Lösungsverhalten[Bearbeiten]
Die an Bauwerken auftretenden Natriumsulfate Thenardit und Mirabilit zählen zur Gruppe der leichtlöslichen und somit leicht mobilisierbaren Salzen (vgl.Tabelle Hygroskopizität der Salze und Gleichgewichtsfeuchte). Die temperaturabhängige Veränderung der Löslichkeit der Natriumsulfate ist groß. Mit dem starken Einfluß der Temperatur auf die Löslichkeit von Thenardit ist die Gefahr einer Lösungsübersättigung bei raschem Temperaturabfall und Kristallisation des Salzes verbunden.
Diagramm 1 - Darstellung der temperaturabhängigen Veränderung der Löslichkeit von Thenardit und Mirabilit im
Vergleich mit anderen Salzphasen [nach Stark/Stürmer 1993].
Hygroskopizität[Bearbeiten]
Im unteren ist der Temperatureinfluß auf die Deliqueszenzpunkte von Thenardit und Mirabilit verdeutlicht. Auffällig sind hierbei die gegenläufigen Kurvengänge.
Diagramm 2 - Deliqueszenzpunkte der Reinsalze Thenardit und Mirabilit [nach Arnold/Zehnder 1991].
In Anwesenheit von Fremdionen (bei Salzgemischen) verändern sich die Parameter der Gleichgewichtsfeuchte und der notwendigen Temperatur- und Feuchtebedingungen für Umkristallisationen zudem deutlich. Als orientierende Daten sind in der unteren Tabelle experimentell erfaßte Werte der Gleichgewichtsfeuchte in unterschiedlichen Salzgemischen wiedergegeben. Es zeigt sich, daß alle Werte der Gleichgewichtsfeuchte unter denen des Reinsalzes Mirabilit liegen.
| RF % | MgSO4 | Ca(NO3)2 | KNO3 |
| Na2SO4 • 10H2O | 87(21°C) | 74 (21°C) | 81(21°C) |
Tabelle 1 - Angaben der Gleichgewichtsfeuchten über gesättigten Mischlösungen (Mischungsverhältnis: Gesättigte Lsg.A/ gesättigte Lsg.B =1:1) [nach Vogt/Goretzki 1993].
Feuchtesorption:
Als weitere Angabe zur Abschätzung der Hygroskopizität von Natriumsulfaten sind in der nachstehenden Tabelle Werte für das Sorptionsverhalten des Reinsalzes und des Gemisches mit Halit bei unterschiedlichen relativen Feuchten wiedergegeben:
Feuchtsorption in M.% nach 56 Tagen Lagerung bei:
| Lagerungsfeuchte | 87% r.F. | 81% r.F. | 79% r.F. |
| Na2SO4 |
79 |
0 |
0 |
| Na2SO4+NaCl (1:1 molare Mischung) | 157 | 32 | 15 |
Tabelle 2 - Sorptionsverhalten von Natriumsulfat [nach Vogt/Goretzki 1993].
Kristallisationsdruck[Bearbeiten]
Bei der Kristallisation aus wäßriger Lösung läßt sich für Thenardit ein Kristallisationsdruck von 29,2-34,5 N/mm2 angeben. Im Vergleich mit den berechneten Angaben der Kristallisationsdrücke anderer bauschädlichen Salze kann Thenardit einen hohen Kristallisationsdruck aufbauen [nach Winkler 1975].
Hydratationsverhalten[Bearbeiten]
Das System Na2SO4 – H2O:
Als nachweisbare, stabile Hydratstufen existieren lediglich das Anhydrit (Thenardit) und das Dekahydrat (Mirabilit). Die Erzeugung von Mirabilit kann durch Rekristallisation des Salzes aus übersättigter, wäßriger Lösung bei einer Temperatur von unter 32,4°C erfolgen. Insbesondere aufgrund der Hydratstufenbildung, der mit einem Einbau von 10 Wassermolekülen in das Kristallgitter und einer Volumenexpansion von rund 320% verbunden ist und der niedrigen Übergangstemperatur von ca. 32-35°C zählen Natriumsulfate zu den sehr verwitterungsaktiven Schadsalzen. Auch dieser Wert ist als Richtwert zu verstehen. Der Phasenübergang Mirabilit – Thenardit kann bei einer Temperatur von 25 °C bei einer relativen Feuchte von ca. 80% stattfinden, beträgt die Umgebungstemperatur 0°C, so ist ein Übergang bereits bei einer r.F. von 60,7% möglich [Angaben nach Gmelin]. Es zeigt sich also auch hier ein starker Temperatureinfluß. Eine Abschätzung der Schadensaktivität durch Kristallisations- und Hydratationsprozesse der Natriumsulfate wird sich an einem Bauwerk bei varierenden Einflußgrößen also sehr schwierig darstellen, da die Klimaparameter das Verhalten extrem beeinflussen.
Hydratationsdruck[Bearbeiten]
Der Hydratationsdruck, der beim Übergang von Thenardit zu Mirabilit aufgebaut wird, ist stark abhängig von den bestehenden Luftfeuchte- und Temperaturverhältnissen, was in der nachstehenden Tabelle verdeutlicht ist:
| rel. Feuchte % | 20,0 °C | 25,0 °C | 30,0 °C |
| 100 | 48,9 N/mm2 | 40,5 N/mm2 | 28,9 N/mm2 |
| 95,0 | 41,3 N/mm2 | 32,7 N/mm2 | 23,3 N/mm2 |
| 90,0 | 33,5 N/mm2 | 24,9 N/mm2 | 13,7 N/mm2 |
| 85,0 | 25,5 N/mm2 | 16,0 N/mm2 | 5,1 N/mm2 |
| 80,0 | 16,4 N/mm2 | 7,8 N/mm2 | 0,0 |
| 75,0 | 6,7 N/mm2 | 0,0 | - |
Tabelle 3 – Hydratationsdruck Thenardit-Mirabilit [nach Winkler/Wilhelm 1970]
Die Volumenveränderung, die beim Phasenübergang stattfindet, ist mit ca. 320% anzugeben [nach Sperling/Cooke 1980].
Umwandlungsreaktionen[Bearbeiten]
Analytischer Nachweis[Bearbeiten]
Mikroskopie
[Bearbeiten]
Laboruntersuchung:
Gips ist gering wasserlöslich, so daß gipshaltiges Probematerial beim Versetzen mit Aquadest. nur geringfügig in Lösung geht. Wird gipshaltiges Probematerial in Lösung gebracht, entstehen bei vorsichtigem Einengen des Lösungmitteltropfens im Zuge der Rekristallisation zunächst Einzelnadeln und zunehmend nadelige Gipsaggregate im Bereich des Saumes der Lösung. (alternativ kann Probematerial mit Salzsäure versetzt werden, was ebenfalls zur Bildung von Kristallnadeln führt). Im Vergleich zu anderen Salzen, die ebenfalls nadelig rekristallisieren können wie z.B. Natriumcarbonat, weisen Gipsnadeln eine deutlich geringere Länge auf.
Brechungsindizes: nx = 1.521; ny =1.523; nz =1.530
Doppelbrechung: Δ = 0.009
Kristallklasse: monoklin
Polarisationsmikroskopische Untersuchung:
Außer dem typischen, nadeligen Habitus von Gipskristallen (v.a. von rekristallisiertem Material) treten unterschiedliche morphologische Charakteristika auf, die bei der Identifikation von Gips hilfreich sind. Gipspartikel (in Rohprobematerial) zeigen sich häufig in Form von gerundeten Splittern und tafeligen Rhomboedern, an denen deutliche, innere Spaltflächen ablesbar sind. Darüber hinaus ist das Auftreten von Zwillingsformen sowohl bei lattigen Partikeln wie auch Tafeln und Plättchen typisch für Gips.
Die Zuweisung der Brechungsindizes erfolgen entsprechend der Immersionsmethode unter Verwendung von Medien mit den Indizes nD=1,518 und nD=1,53, wobei aufgrund der zumeist sehr kleinteiligen Partikel die Überprüfung des Schroeder van der Kolk- Schatten aussagekräftiger und sicherer ist, als der Becke-Linien Test.
Gipskristalle gehören zur Klasse der monoklinen Kristalle zeigen also je nach Ausrichtung des Einzelpartikels unter dem Mikroskop zum einen sowohl parallele, bzw. symmetrische Auslöschung, weisen v.a. jedoch eine charakteristische schiefe Achsenstellung in der Auslöschungsposition auf. An gut ausgebildeten Kristallrhomben ist diese schiefe Auslöschung zumeist klar meßbar.
Von allen Calciumsulfaten ist Gips am geringsten doppelbrechend und erscheint bei gekreuzten Polarisatoren mit sehr niedrigen Interferenzfarben, die (natürlich in Abhängigkeit der vorliegenden Partikeldicke) im Bereich grau bis gelblich weiß der ersten Ordnung liegen.
Verwechslungsmöglichkeiten:
Gips ist im dargestellten Analyseverfahren eindeutig zuweisbar, sofern die folgenden Untersuchungskriterien eindeutig geklärt sind:
- geringe Wasserlöslichkeit
- charakteristisch nadelige Morphologie bei rekristallisierten Partikeln
- alle beobachtbaren Indizes besitzen einen nD –Wert zwischen 1,518 und 1,530
- Gipskristalle besitzen eine geringe Doppelbrechung und niedrige Interferenzfarben
- Gipskristalle weisen eine schiefe Auslöschung auf
Salzphasen, die gipsähnliche chemische und optische Eigenschaften aufweisen, sind nachstehend
aufgelistet:
| Salzphase | Unterscheidungsmerkmale zu Gips |
| Syngenit; K2Ca(SO4)•2H2O | alle beobachtbaren Indizes < 1,518 |
| Tachyhydrit; CaMg2Cl6•12H2O | zumeist ein beobachtbarer Index < 1,518 / nur parallele und symmetrische Auslöschung |
| Hydromagnesit; Mg5[OH(CO3)2]2•4H2O | ein Index zumeist > 1,53 |
Röntgendiffraktometrie[Bearbeiten]
Raman-Stektroskopie[Bearbeiten]
DTA/TG[Bearbeiten]
IR-Spektroskopie[Bearbeiten]
Umgang mit Gipsschäden[Bearbeiten]
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
- Auf dem Objektträger rekristallisiert
- Gips-1.jpg
Gipskristalle unter polarisiertem Licht
- Gips-2.jpg
Gipskristalle unter polarisiertem Licht, Rot I
- Im Dünnschliff von Objektproben
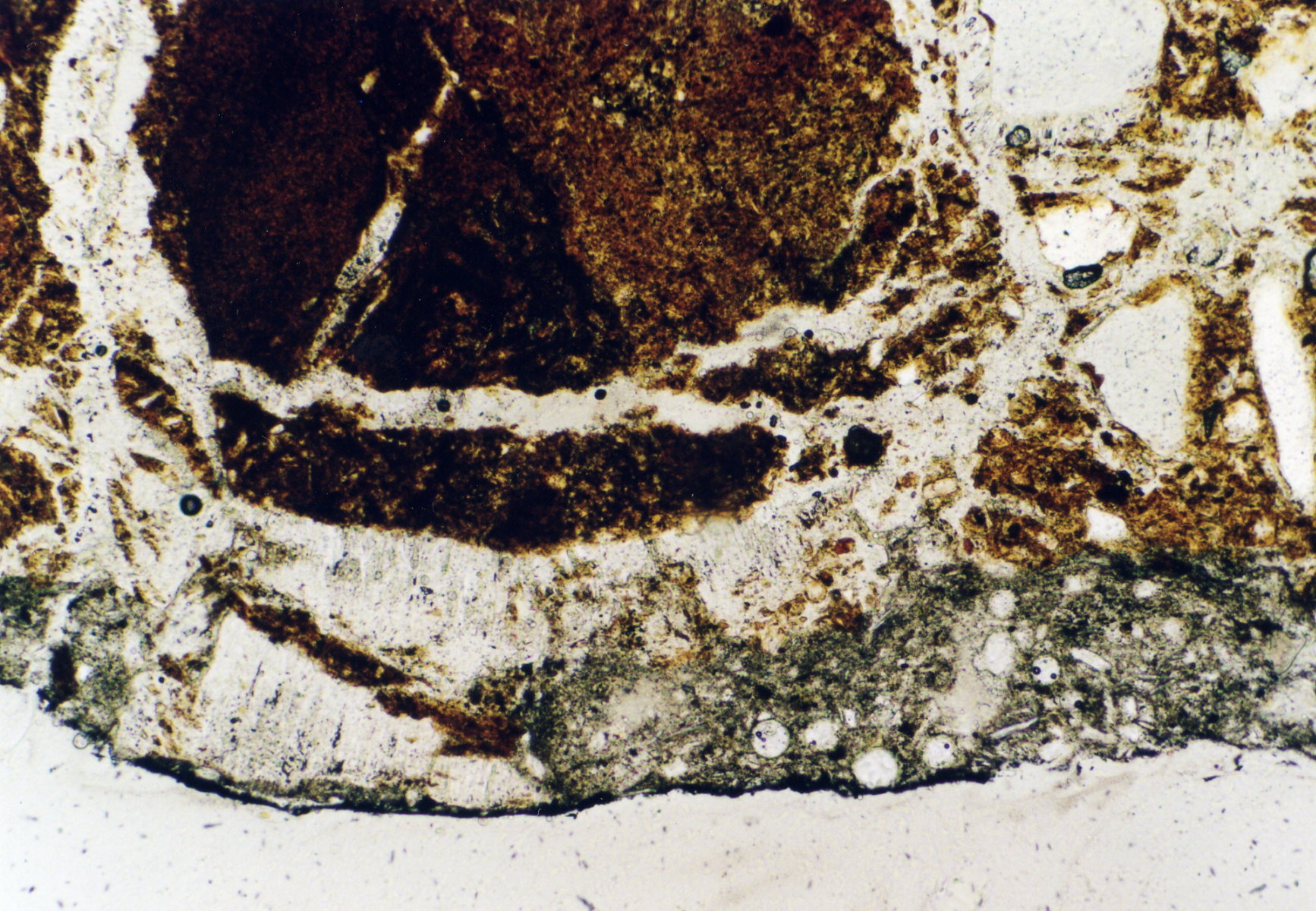
- Per 270603 5-13 16.jpg
Gipsgeschädigter Ziegel, St. Jakobi Perleberg
Unter dem Rasterelektronenmikroskop[Bearbeiten]
- Im Rasterelektronenmikoskop
- CaSO4-REM-SG2-1.jpeg
Gipskristalle im REM
- CaSO4-REM-SG2-2.jpeg
Gipskristalle im REM
- CaSO4-REM-SG2-3.jpeg
Gipskristalle im REM
- CaSO4-REM-SG2-SPC.jpeg
Gipskristalle im REM
- CaSO4-REM-SG3-1.jpeg
Gipskristalle im REM
- CaSO4-REM-SG3-2.jpeg
Gipskristalle im REM
- CaSO4-REM-SG3-3.jpeg
Gipskristalle im REM
- CaSO4-REM-SG3-SPC2.jpeg
Gipskristalle im REM
Weblinks
[Bearbeiten]
http://webmineral.com/data/Gypsum.shtml
http://www.mindat.org/min-1784.html
http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Gips
Literatur[Bearbeiten]
<bibreferences/>