Was sind Salze?
<bibimport />
Autoren: Hans-Jürgen Schwarz, NN
zurück zu Grundlagen
Abstract[Bearbeiten]
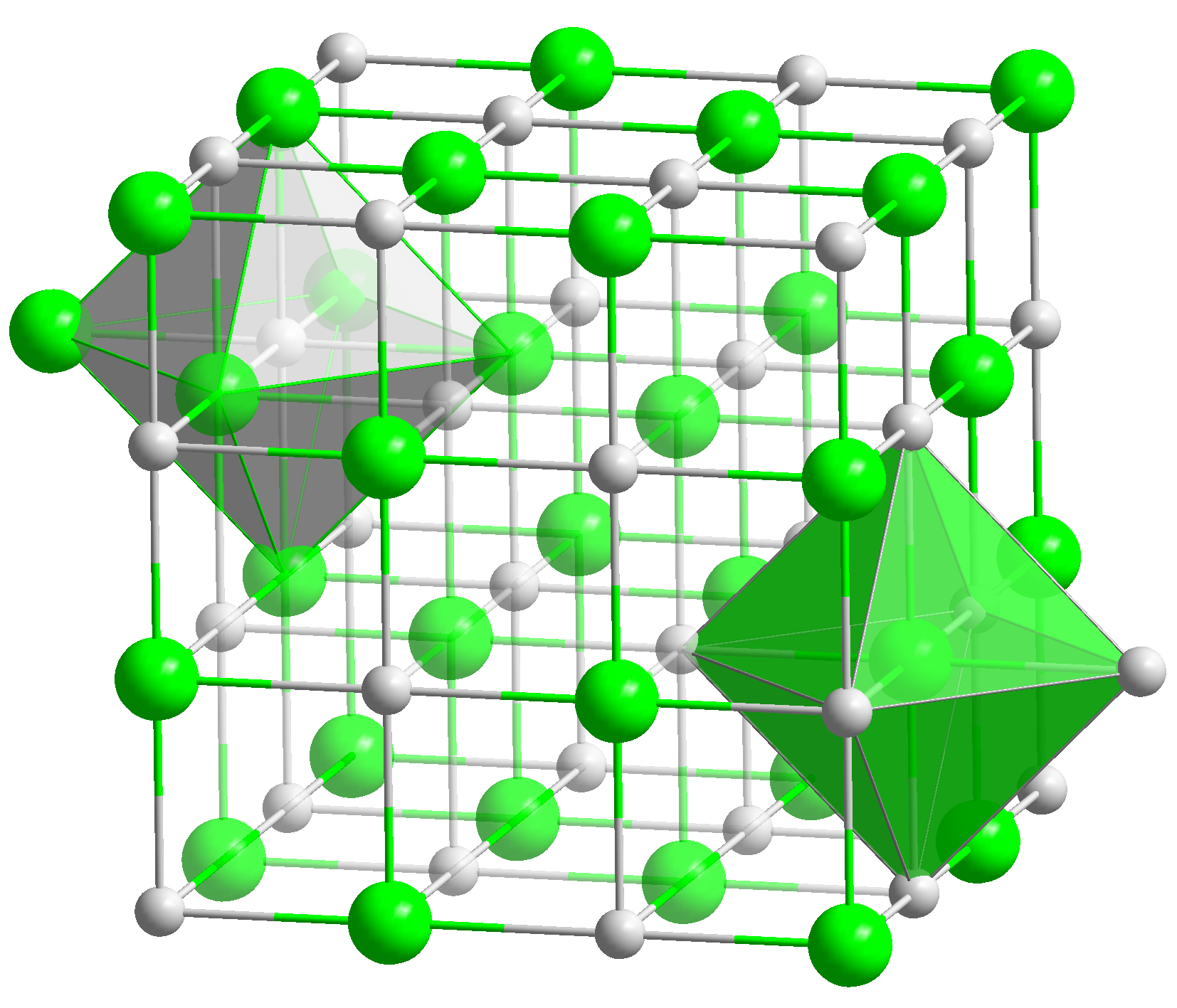
Salze bestehen aus Metallkationen (z. B. K+, Ca2+) oder einer basichen Atomgruppe (z.B. NH4+) und Säurerestanionen (z.B Nitrat), die durch eine Ionenbindung zusammengehalten werden. Sie sind kristallin.
Aufbau der Salze[Bearbeiten]
Salze bestehen in der Regel aus positiv geladenen Ionen, den Kationen, und negativ geladenen Ionen, den Anionen, die ein Kristallgitter aufbauen. Zusätzlich findet sich oft im Kristallgitter noch Wasser (H2O).
Salze entstehen z. B. bei der Neutralisationsreaktion, d. h. beim Zusammentreffen einer Säure mit einer Base.
Base + Säure → Salz + Wasser
Bei der Reaktion einer Säure mit einer Base entsteht nicht immer ein neutrales Salz. Es gibt auch basische und saure Salze, je nachdem wie stark die Säuren bzw. Basen sind, die an der Reaktion beteiligt sind:
1. starke Säure + starke Base → neutrales Salz + H2O
2. starke Säure + schwache Base → saures Salz + H2O
3. schwache Säure + starke Base → basisches Salz + H2O
z.B.
1. H3O+ + Cl- + Na+ + OH- → NaCl + H2O
2. H3O+ + Cl- + NH3 → NH4Cl + H2O
3. H3O++ HCO3- + 2Na+ + 2OH- → Na2CO3 + 3H2O
Manche Salze unterscheiden sich nur in der Zahl der Wassermoleküle im Kristallgitter wie z. B. Thermonatrit = Na 2CO3•H2O und Natrit = Na2CO3 •10 H2O
Die Formel von Salzen schreibt man:
(positives Ion (Kation))X (negatives Ion (Anion))Y • nH2O : z.B. CaCl2 • 6 H2O
mit x,y,n Zahl der Ionen bzw. Wassermoleküle
| Salze bestehen aus Metallkationen oder einer basichen Atomgruppe und Säurerestanionen, die durch eine Ionenbindung zusammengehalten werden. Sie sind kristallin. |
Welche Ionen bauen die Salze auf?[Bearbeiten]
Bauschädlichen Salze[Bearbeiten]
Die bauschädlichen Salze bestehen zu über 90% aus den
Anionen
- Sulfat SO42-
- Nitrat NO3-
- Chlorid Cl-
- Carbonat CO32-
und den Kationen
- Natrium Na+
- Kalium K+
- Calcium Ca2+
- Magnesium Mg2+
weitere Anionen sind:
- Acetat CH3COO-
- Formiat HCOO-
- Oxalat C2O42-
- Phosphat PO43-
weitere Kationen sind:
- Ammonium NH4+
Eigenschaften der Salze[Bearbeiten]
SAlze besutzen vieel Eigenschaften, die Ihr Verhjakten in Lösung udn auch als Schadsalz an den Objekten erklärn helfen.
Zu diesen Eigenschaften gehören:
- Löslichkeit
- Elektrische Leitfähigkeit
- Wärmeleitfähigkeit
- Festigkeit
- Dichte
- Härte
- Schmelzpunkt
- Wärmedehnung
- Farbe
- Glanz
- Lumineszenz