ECOS-Runsalt: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (4 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 5: | Zeile 5: | ||
==Abstract== | ==Abstract== | ||
Das Programm <i>ECOS-Runsalt</i> (<i>ECOS</i>=<i>environmental control of salts</i>), welches die Berechnung von Kristallisationsabfolgen von Salzgemischen ermöglicht, wird vorgestellt. Neben einer kurzen Erläuterung zur Durchführung der Berechnungen wird auch auf mögliche Fehlerquellen hingewiesen. | |||
Ein Download der aktuellen Version ist über die Seite [[Software]] möglich. | |||
==Anwendungsbereich des Programms== | |||
Die Untersuchung der Versalzungssituation eines Objekts und die Einstufung eines möglichen Schädigungspotentials, gegeben durch vorliegende Salze und umgebende klimatische Bedingungen, sind in der Konservierung von Kulturgut wichtige Faktoren. Werden Baustoffproben auf ihre enthaltenen Ionen untersucht, kann das Programm <i>ECOS-Runsalt</i> verwendet werden, um die Kristallisationsabfolge aus dem Gemisch zu bestimmen und um kritische klimatische Bedingungen für Phasenumwandlungen zu ermitteln. Neben einer präventiven Konservierung über die Reduzierung von Salzgehalten kann auch eine Einstellung umgebender klimatischer Bedingungen dafür genutzt werden, sofern die Lokation des entsprechenden Objekts dies zulässt (vom Außenklima abgekoppelte Bereiche). Sind jene klimatische Bedingungen bekannt, bei denen es zu kritischen Phasenumwandlungen kommt, demnach Kristallisation und Auflösung oder auch Hydratation und Dehydratation, kann versucht werden, die Über- oder Unterschreitung dieser Grenzwerte zu verhindern. Für die Objekte kritisch zu sehende, zyklische Kristallisations- und Auflösungsabfolgen können so unter Umständen vermieden werden. | |||
==Verwendung des Programms== | |||
Das Programm <i>ECOS-Runsalt</i> basiert auf der Modellierung chemischer Gleichgewichte, die eine thermodynamische Betrachtung von Phasenumwandlungen und Wechselwirkungen mit dem umgebenden Klima beinhaltet. Die ursprüngliche Version des Programms <i>ECOS</i> (<i>environmental control of salts</i>) <bib id="Price:2000"/> wurde bis 2000 in einer von der Europäischen Union geförderten Kooperation zwischen dem University College London, der Universität East Anglia Norwich und der Universität Hamburg erstellt. Mit der Erweiterung <i>ECOS-Runsalt</i> <bib id="Bionda:2006"/> wurden die Benutzeroberfläche und Anwendung verbessert. | |||
Das Programm <i>ECOS-Runsalt</i> basiert auf der Modellierung chemischer Gleichgewichte | |||
Eingabedaten sind die Gehalte der am häufigsten in realen Objekten vorliegenden Ionen Ca<sup>2+</sup>, Mg<sup>2+</sup>, K<sup>+</sup>, Na<sup>+</sup>, SO<sub>4</sub><sup>2-</sup>, NO<sub>3</sub><sup>-</sup> und Cl<sup>-</sup>. Diese Daten können aus Ergebnissen analytischer Untersuchungen von Extrakten von Baustoffproben oder Effloreszenzen stammen. Das Kristallisationsverhalten des eigegebenen Gemischs kann entweder bei einer gegebenen relativen Luftfeuchtigkeit in einem Bereich der Temperatur bestimmt werden oder bei einer gegebenen Temperatur in einem Bereich der relativen Luftfeuchtigkeit. | |||
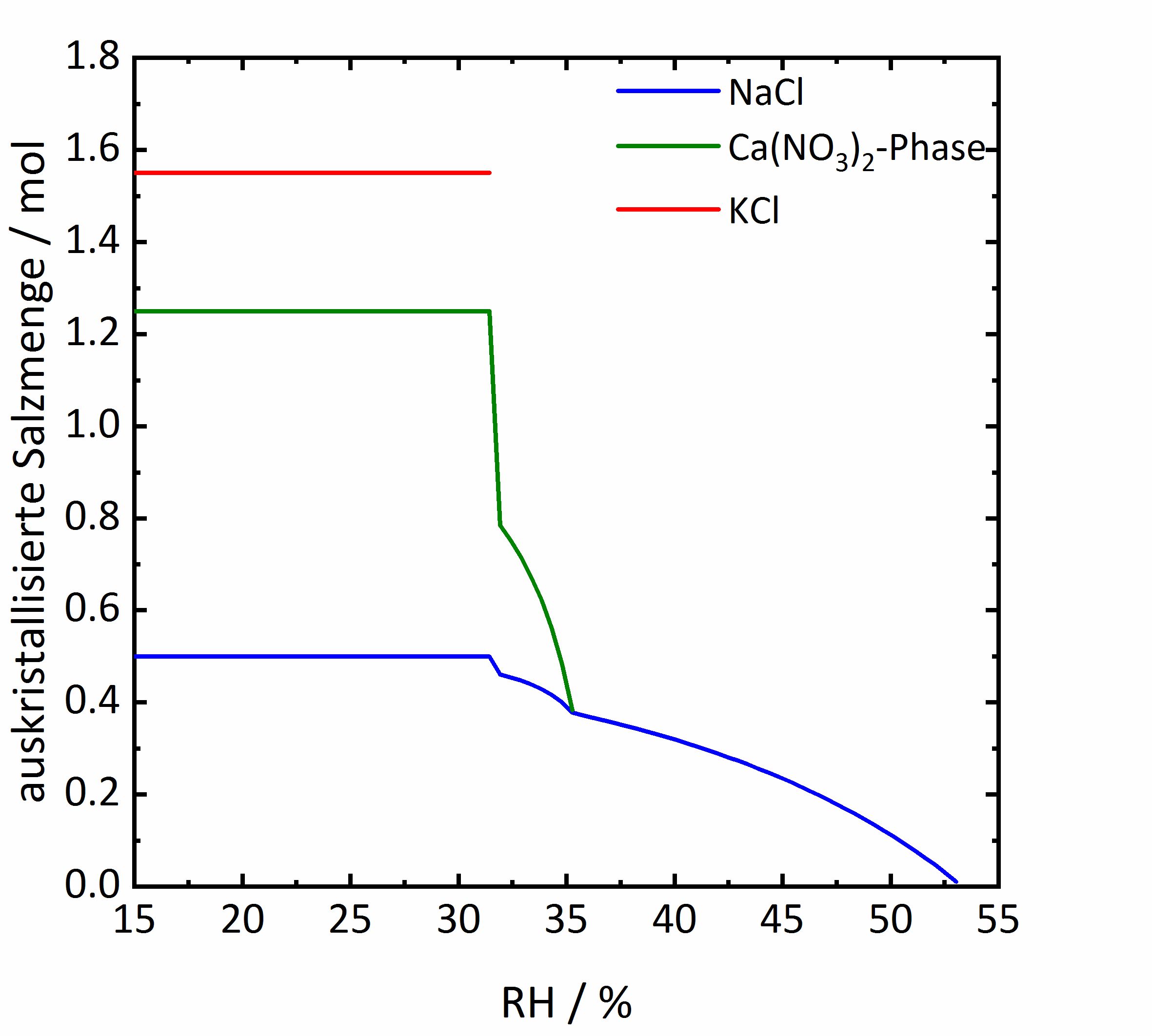
Das Diagramm in Abbildung 1 zeigt das Ergebnis einer Berechnung für eine konstante Temperatur von 23 °C, die für eine fiktive Mischung aus Natrium-, Kalium-, Calcium-, Nitrat- und Chlorid-Ionen erhalten wurde. Es ist erkennbar, dass ab etwa 53 %RH die Kristallisation von Natriumchlorid einsetzt. Die Luftfeuchtigkeit, bei der die Kristallisation der ersten Phase einsetzt, wird als kritische Kristallisationsfeuchte bezeichnet. Bei etwa 35 %RH setzt die Kristallisation einer Calciumnitrat-Phase ein, gefolgt von Kaliumchlorid bei 31 %RH. Diese relative Luftfeuchtigkeit entspricht dem endgültigen Trocknungspunkt des Gemischs und wird als gemeinsame Deliqueszenzfeuchte bezeichnet. Anhand der Kristallisationsverläufe ist gut erkennbar, dass bei Salzmischungen ein Bereich der relativen Luftfeuchtigkeit berücksichtigt werden muss, in welchem es zur Kristallisation der verschiedenen Phasen kommt, so dass die Kristallisation schrittweise und nicht punktuell bei Erreichen eines bestimmten Werts der Luftfeuchtigkeit auftritt. Zudem wären für diesen konkreten Fall relative Luftfeuchtigkeiten oberhalb von 53 %RH günstig, da es dann zu keinen Kristallisationsprozessen kommt. | |||
[[File:ECOS Beispiel.jpg|400px|thumb|left|'''Abbildung 1''': Kristallisationabfolge einer fiktiven Salzmischung bei 23 °C, berechnet mit <i>ECOS-Runsalt</i>. Aufgetragen ist die auskristallisierte Salzemenge in mol gegen die relative Luftfeuchtigkeit.]] | |||
<br clear=all> | |||
Das Programm ermöglicht die Vorhersage von Kristallisationsverläufen für verschiedenste Gemische, in denen die berücksichtigten Ionen vorliegen. Bei der Verwendung des Programms und der Bewertung und Interpretation der Ergebnisse sowie bei den Eingabedaten müssen jedoch einige Aspekte berücksichtigt werden. | |||
Wie bereits erwähnt, beruht das Programm auf Gleichgewichtsmodellen. Demnach wird bei den Berechnungen stets vom Vorliegen eines chemischen Gleichgewichts ausgegangen. Treten kinetische Effekte wie metastabile Phasen oder Übersättigungen auf, liegt ein solches aber nicht mehr vor und das Modell kann keine zuverlässigen Aussagen treffen. Auch die Fraktionierung von Salzen als Folge von Transportprozessen im Objekt können nicht berücksichtigt werden <bib id="Steiger.etal:2012"/>. | |||
Bei dem Programm wird davon ausgegangen, dass sich während des gesamten Kristallisationsablaufs die bereits auskristallisierten Phasen noch in Kontakt mit der verbleibenden Lösung befinden. Somit kann es in einigen Gemischen auch sein, dass sich eine zunächst gebildete Phase sich im weiteren Verlauf wieder auflöst. An realen Objekten, bei denen es zum Lösungstransport kommt, kann dies allerdings nicht erfolgen, da das auskristallisierte Salz am Ort der Bildung immobilisiert wird, während die verbleibende Lösung weiter transportiert wird <bib id="Arnold.etal:1991"/>. Die auskristallisierte Phase wird sich in diesem Fall nicht wieder lösen können, wodurch sich eine Kristallisationsabfolge ergibt, die von der mit <i>ECOS-Runsalt</i> vorhergesagten Abfolge abweicht <bib id="Steiger:2009a"/>. | |||
<i> | Fehlerquellen bei der Bestimmung einer Kristallisationsabfolge mittels <i>ECOS-Runsalt</i> sind zum einen durch die Fehler der bei der Ermittlung der Ionenzusammensetzung in einer Probe verwendeten analytischen Verfahren gegeben. Die in den analytischen Verfahren ermittelten positiven und negativen Ladungen müssen per Definition ausgeglichen sein. Durch die Messungenauigkeit einer jeden Methode ist dies nicht exakt erreichbar. Das Ausmaß der Abweichung kann jedoch zur Bewertung der Zuverlässigkeit und Qualität der Daten verwendet werden. Die Ladungsbilanz <i>B<sub>z</sub></i> kann anhand der folgenden Gleichung berechnet werden: | ||
<i>B<sub>z</sub></i>=2(<i>E</i><sub>c</sub>-<i>E</i><sub>a</sub>)/(<i>E</i><sub>c</sub>+<i>E</i><sub>a</sub>) (Gl. 1). | |||
<i> | Hierbei sind <i>E</i><sub>c</sub>=∑<sub>c</sub><i>c</i><sub>eq,c</sub> und <i>E</i><sub>a</sub>=∑<sub>a</sub><i>c</i><sub>eq,a</sub> die Gesamtäquivaltenkonzentrationen der Kationen und der Anionen. Die Äquivalentkonzentration <i>c</i><sub>eq,i</sub> berücksichtigt die Ladung der jeweiligen Ionen (<i>c</i><sub>eq,i</sub>=|<i>z</i><sub>i</sub>|∙<i>m</i><sub>i</sub>). Die Molalität <i>m</i><sub>i</sub> des jeweiligen Ions liegt in der Einheit mol/kg vor, <i>z</i><sub>i</sub> ist die Ladung des jeweiligen Ions. Sind die Ergebnisse der analytischen Messungen in anderen Einheiten angegeben, muss zunächst eine Umrechnung erfolgen. <bib id="Steiger.etal:2012"/> | ||
Im Betrag sollte <i>B<sub>z</sub></i> keine größere Abweichung als 0.05 bis 0.1 aufweisen. | Im Betrag sollte <i>B<sub>z</sub></i> keine größere Abweichung als 0.05 bis 0.1 aufweisen. Größere Abweichungen deuten auf Fehler in der analytischen Bestimmung oder weitere, zunächst nicht bestimmte Ionen hin. Diese anderen Ionen wie Ammonium, Barium, Formiat oder Acetat können aufgrund von Umwelt- oder anthropogenen Einflüssen sowie vorherigen restauratorischen Eingriffen vorliegen, aber auch alkalische Baustoffe können ein Quelle für weitere Ionen sein. | ||
Systematische Kationenüberschüsse, die bei abnehmenden Salzgehalten größer werden, können durch ein teilweises Anlösen von Calcit während der Extraktion der Baustoffproben entstehen, sofern Carbonat-haltige Materialien vorliegen. Dabei resultieren Ca<sup>2+</sup>- und HCO<sub>3</sub><sup>-</sup>-Ionen, von denen aber nur Ca<sup>2+</sup>-Ionen bestimmt werden. Der Calcium-Gehalt aus diesem Prozess kann aber maximal der Löslichkeit vom Calcit im Extraktionsverhältnis entsprechen. Die geringe Löslichkeit des Calcits ist hier also zu berücksichtigen. Zudem hat das indirekt ermittelte Calcit aus konservatorischer Sicht keine Relevanz, da es aufgrund seiner geringen Löslichkeit kein Salz ist, welches aktiv am Schädigungsprozess im Zuge der Salzkristallisation teilnimmt. Der maximal vertretbare Kationenüberschuss ergibt sich aus dem maximal möglichen Calcium-Gehalt und der analytischen Messungenauigkeit. Liegen trotz der Berücksichtigung der teilweisen Lösung von Calcit weitere Kationenüberschüsse vor, können weitere Carbonat- oder Bicarbonat-Gehalte aus besser löslichen Alkalicarbonaten vorliegen. Da Carbonat-Ionen im <i>ECOS</i>-Modell jedoch nicht berücksichtigt werden, kann <i>ECOS</i> in diesem Fall nicht für das vorliegende Salzgemisch verwendet werden. <bib id="Steiger.etal:2012"/> | |||
Nicht nur die analytischen Verfahren können fehlerbehaftet sein, auch das thermodynamische Modell kann Fehlerquellen beinhalten <bib id="Steiger.etal:2008c"/>. Im System MgSO<sub>4</sub>-H<sub>2</sub>O werden einige Umwandlungsbedingungen und Stabilitätsbereiche von Hydratphasen nicht korrekt angegeben <bib id="Bionda:2006"/>. In einer mit dem Programm ermittelten Kristallisationsabfolge ist das Auftreten einer Magnesiumsulfat-Phase trotzdem richtig vorhergesagt, jedoch muss berücksichtigt werden, dass es sich bei der angegebenen Hydratstufe nicht zwingend um die richtige handelt. Um dies zu überprüfen, kann das Phasendiagramm des Systems hinzugezogen werden. <bib id="Steiger:2009a"/> | |||
Nicht nur die analytischen Verfahren können fehlerbehaftet sein, auch das thermodynamische Modell kann Fehlerquellen beinhalten | |||
Ein weiterer wichtiger Aspekt, der bei dem Einsatz von <i>ECOS-Runsalt</i> zur Auswertung von | Ein weiterer wichtiger Aspekt, der bei dem Einsatz von <i>ECOS-Runsalt</i> zur Auswertung von Kristallisationsabfolgen berücksichtigt werden muss, ist, dass Gips im Programm nicht einbezogen wird. Der Grund dafür ist die sehr geringe Löslichkeit von Gips und von anderen, besser löslichen Salzen abweichende Schädigungsmechanismen. Die Vernachlässigung führt zu einer besseren Handhabbarkeit des Programms, da die Anzahl der benötigten Parameter reduziert werden kann. Gips stellt zwar eines der am häufigsten an Bauwerken vorkommenden Salze dar, hat jedoch eine sehr geringe Löslichkeit und eine hohe Deliqueszenzfeuchte. Kristallisiert Gips aus, ist es zunächst immobilisiert und eine Auflösung des Salzes ist nur durch Flüssigwassereintrag möglich. Folglich wird es durch klimatische Schwankungen kaum beeinflusst und sein Einfluss auf das Kristallisationsverhalten anderer Salze ist ebenfalls gering. Die Vernachlässigung des Salzes ist somit legitim, sofern sie sich nur auf seine Berücksichtigung in <i>ECOS-Runsalt</i> und nicht im Bereich der Objektschädigung bezieht. Die vom Gips resultierenden Sulfat- und Calcium-Ionen müssen vor der Eingabe der analytischen Daten in <i>ECOS-Runsalt</i> abgezogen werden. <bib id="Steiger.etal:2012"/> | ||
Vorgehensweise zur Verwendung von <i>ECOS</i>: | Vorgehensweise zur Verwendung von <i>ECOS</i>:<br> | ||
- Analytische Bestimmung vorliegender Ionen. | - Analytische Bestimmung vorliegender Ionen.<br> | ||
- Bestimmung der Ladungsbilanz und Betrachtung der Ergebnisse hinsichtlich akzeptabler prozentualer Abweichungen. | - Bestimmung der Ladungsbilanz und Betrachtung der Ergebnisse hinsichtlich akzeptabler prozentualer Abweichungen. Es muss eine Abwägung erfolgen, ob die Abweichungen akzeptabel sind, so dass eine Korrektur der Ladungsbilanz erfolgen kann, oder ob auf die Verwendung von <i>ECOS</i> verzichtet werden muss. Bei Kationenüberschüssen ist gegebenenfalls das teilweise Lösen von Calcit zu betrachtet und nur die Calciumkonzentration zu korrigieren. <bib id="Steiger.etal:2012"/><br> | ||
- Korrektur hinsichtlich Gips. | - Korrektur hinsichtlich Gips.<br> | ||
- Eingabe der korrigierten Ionen-Gehalte in <i>ECOS</i>. | - Eingabe der korrigierten Ionen-Gehalte in <i>ECOS</i>.<br> | ||
- | - Eingabe einer festen Temperatur oder einer relativen Luftfeuchtigkeit sowie eines Bereichs der relativen Luftfeuchtigkeit beziehungsweise der Temperatur. | ||
Liegt bei den eigegebenen Ionengehalten weiterhin eine unausgeglichene Ionenbilanz vor, gibt das Programm einen Hinweis darauf und bietet eine integrierte Autokorrekturfunktion an. Auf die Anwendung dieser sollte möglichst verzichtet werden, da hier eine proportionale Korrektur aller Anionen beziehungsweise aller Kationen vorgenommen wird. Die Überprüfung der Eingabedaten sollte | Liegt bei den eigegebenen Ionengehalten weiterhin eine unausgeglichene Ionenbilanz vor, gibt das Programm einen Hinweis darauf und bietet eine integrierte Autokorrekturfunktion an. Auf die Anwendung dieser sollte möglichst verzichtet werden, da hier eine proportionale Korrektur aller Anionen beziehungsweise aller Kationen vorgenommen wird. Die Überprüfung der Eingabedaten sollte manuell erfolgen. <bib id="Steiger.etal:2012"/>, <bib id="Steiger:2009a"/> | ||
Mit dem Programm <i>ECOS-Runsalt</i> ist es also möglich, die Kristallisationsabfolge in Abhängigkeit der relativen Luftfeuchtigkeit oder Temperatur vorherzusagen, es müssen aber die Grenzen des mathematischen Modells und | Mit dem Programm <i>ECOS-Runsalt</i> ist es also möglich, die Kristallisationsabfolge in Abhängigkeit der relativen Luftfeuchtigkeit oder der Temperatur vorherzusagen, es müssen aber die Grenzen des mathematischen Modells und der analytischen Methoden sowie Fehlerquellen bei deren Interpretation berücksichtigt werden. | ||
== Literatur == | |||
<biblist/> | |||
-- | [[Category:ECOS-Runsalt]][[Category:ECOS]][[Category:Stahlbuhk,Amelie]][[Category:R-MSteiger]] | ||
Aktuelle Version vom 25. März 2019, 14:38 Uhr
Autor: Amelie Stahlbuhk
zurück zu SalzWiki:Portal
Abstract[Bearbeiten]
Das Programm ECOS-Runsalt (ECOS=environmental control of salts), welches die Berechnung von Kristallisationsabfolgen von Salzgemischen ermöglicht, wird vorgestellt. Neben einer kurzen Erläuterung zur Durchführung der Berechnungen wird auch auf mögliche Fehlerquellen hingewiesen. Ein Download der aktuellen Version ist über die Seite Software möglich.
Anwendungsbereich des Programms[Bearbeiten]
Die Untersuchung der Versalzungssituation eines Objekts und die Einstufung eines möglichen Schädigungspotentials, gegeben durch vorliegende Salze und umgebende klimatische Bedingungen, sind in der Konservierung von Kulturgut wichtige Faktoren. Werden Baustoffproben auf ihre enthaltenen Ionen untersucht, kann das Programm ECOS-Runsalt verwendet werden, um die Kristallisationsabfolge aus dem Gemisch zu bestimmen und um kritische klimatische Bedingungen für Phasenumwandlungen zu ermitteln. Neben einer präventiven Konservierung über die Reduzierung von Salzgehalten kann auch eine Einstellung umgebender klimatischer Bedingungen dafür genutzt werden, sofern die Lokation des entsprechenden Objekts dies zulässt (vom Außenklima abgekoppelte Bereiche). Sind jene klimatische Bedingungen bekannt, bei denen es zu kritischen Phasenumwandlungen kommt, demnach Kristallisation und Auflösung oder auch Hydratation und Dehydratation, kann versucht werden, die Über- oder Unterschreitung dieser Grenzwerte zu verhindern. Für die Objekte kritisch zu sehende, zyklische Kristallisations- und Auflösungsabfolgen können so unter Umständen vermieden werden.
Verwendung des Programms[Bearbeiten]
Das Programm ECOS-Runsalt basiert auf der Modellierung chemischer Gleichgewichte, die eine thermodynamische Betrachtung von Phasenumwandlungen und Wechselwirkungen mit dem umgebenden Klima beinhaltet. Die ursprüngliche Version des Programms ECOS (environmental control of salts) [Price:2000]Titel: An expert chemical model for determining the environmental conditions needed to prevent salt damage in porous materials : protection and conservation of the European cultural heritage
Autor / Verfasser: Price, C. wurde bis 2000 in einer von der Europäischen Union geförderten Kooperation zwischen dem University College London, der Universität East Anglia Norwich und der Universität Hamburg erstellt. Mit der Erweiterung ECOS-Runsalt [Bionda:2006]Titel: Modelling indoor climate and salt behaviour in historical buildings: A case study, Diss. Nr. 16567
wurde bis 2000 in einer von der Europäischen Union geförderten Kooperation zwischen dem University College London, der Universität East Anglia Norwich und der Universität Hamburg erstellt. Mit der Erweiterung ECOS-Runsalt [Bionda:2006]Titel: Modelling indoor climate and salt behaviour in historical buildings: A case study, Diss. Nr. 16567
Autor / Verfasser: Bionda, Davide wurden die Benutzeroberfläche und Anwendung verbessert.
wurden die Benutzeroberfläche und Anwendung verbessert.
Eingabedaten sind die Gehalte der am häufigsten in realen Objekten vorliegenden Ionen Ca2+, Mg2+, K+, Na+, SO42-, NO3- und Cl-. Diese Daten können aus Ergebnissen analytischer Untersuchungen von Extrakten von Baustoffproben oder Effloreszenzen stammen. Das Kristallisationsverhalten des eigegebenen Gemischs kann entweder bei einer gegebenen relativen Luftfeuchtigkeit in einem Bereich der Temperatur bestimmt werden oder bei einer gegebenen Temperatur in einem Bereich der relativen Luftfeuchtigkeit.
Das Diagramm in Abbildung 1 zeigt das Ergebnis einer Berechnung für eine konstante Temperatur von 23 °C, die für eine fiktive Mischung aus Natrium-, Kalium-, Calcium-, Nitrat- und Chlorid-Ionen erhalten wurde. Es ist erkennbar, dass ab etwa 53 %RH die Kristallisation von Natriumchlorid einsetzt. Die Luftfeuchtigkeit, bei der die Kristallisation der ersten Phase einsetzt, wird als kritische Kristallisationsfeuchte bezeichnet. Bei etwa 35 %RH setzt die Kristallisation einer Calciumnitrat-Phase ein, gefolgt von Kaliumchlorid bei 31 %RH. Diese relative Luftfeuchtigkeit entspricht dem endgültigen Trocknungspunkt des Gemischs und wird als gemeinsame Deliqueszenzfeuchte bezeichnet. Anhand der Kristallisationsverläufe ist gut erkennbar, dass bei Salzmischungen ein Bereich der relativen Luftfeuchtigkeit berücksichtigt werden muss, in welchem es zur Kristallisation der verschiedenen Phasen kommt, so dass die Kristallisation schrittweise und nicht punktuell bei Erreichen eines bestimmten Werts der Luftfeuchtigkeit auftritt. Zudem wären für diesen konkreten Fall relative Luftfeuchtigkeiten oberhalb von 53 %RH günstig, da es dann zu keinen Kristallisationsprozessen kommt.
Das Programm ermöglicht die Vorhersage von Kristallisationsverläufen für verschiedenste Gemische, in denen die berücksichtigten Ionen vorliegen. Bei der Verwendung des Programms und der Bewertung und Interpretation der Ergebnisse sowie bei den Eingabedaten müssen jedoch einige Aspekte berücksichtigt werden.
Wie bereits erwähnt, beruht das Programm auf Gleichgewichtsmodellen. Demnach wird bei den Berechnungen stets vom Vorliegen eines chemischen Gleichgewichts ausgegangen. Treten kinetische Effekte wie metastabile Phasen oder Übersättigungen auf, liegt ein solches aber nicht mehr vor und das Modell kann keine zuverlässigen Aussagen treffen. Auch die Fraktionierung von Salzen als Folge von Transportprozessen im Objekt können nicht berücksichtigt werden [Steiger.etal:2012]Titel: Modelling the crystallization behaviour of mixed salt systems: input data requirements.
Autor / Verfasser: Steiger, M.; Heritage, A. .
Bei dem Programm wird davon ausgegangen, dass sich während des gesamten Kristallisationsablaufs die bereits auskristallisierten Phasen noch in Kontakt mit der verbleibenden Lösung befinden. Somit kann es in einigen Gemischen auch sein, dass sich eine zunächst gebildete Phase sich im weiteren Verlauf wieder auflöst. An realen Objekten, bei denen es zum Lösungstransport kommt, kann dies allerdings nicht erfolgen, da das auskristallisierte Salz am Ort der Bildung immobilisiert wird, während die verbleibende Lösung weiter transportiert wird [Arnold.etal:1991]Titel: Monitoring Wall Paintings Affected by soluble Salts
.
Bei dem Programm wird davon ausgegangen, dass sich während des gesamten Kristallisationsablaufs die bereits auskristallisierten Phasen noch in Kontakt mit der verbleibenden Lösung befinden. Somit kann es in einigen Gemischen auch sein, dass sich eine zunächst gebildete Phase sich im weiteren Verlauf wieder auflöst. An realen Objekten, bei denen es zum Lösungstransport kommt, kann dies allerdings nicht erfolgen, da das auskristallisierte Salz am Ort der Bildung immobilisiert wird, während die verbleibende Lösung weiter transportiert wird [Arnold.etal:1991]Titel: Monitoring Wall Paintings Affected by soluble Salts
Autor / Verfasser: Arnold, Andreas; Zehnder, Konrad . Die auskristallisierte Phase wird sich in diesem Fall nicht wieder lösen können, wodurch sich eine Kristallisationsabfolge ergibt, die von der mit ECOS-Runsalt vorhergesagten Abfolge abweicht [Steiger:2009a]Titel: Modellierung von Phasengleichgewichten
. Die auskristallisierte Phase wird sich in diesem Fall nicht wieder lösen können, wodurch sich eine Kristallisationsabfolge ergibt, die von der mit ECOS-Runsalt vorhergesagten Abfolge abweicht [Steiger:2009a]Titel: Modellierung von Phasengleichgewichten
Autor / Verfasser: Steiger, Michael .
.
Fehlerquellen bei der Bestimmung einer Kristallisationsabfolge mittels ECOS-Runsalt sind zum einen durch die Fehler der bei der Ermittlung der Ionenzusammensetzung in einer Probe verwendeten analytischen Verfahren gegeben. Die in den analytischen Verfahren ermittelten positiven und negativen Ladungen müssen per Definition ausgeglichen sein. Durch die Messungenauigkeit einer jeden Methode ist dies nicht exakt erreichbar. Das Ausmaß der Abweichung kann jedoch zur Bewertung der Zuverlässigkeit und Qualität der Daten verwendet werden. Die Ladungsbilanz Bz kann anhand der folgenden Gleichung berechnet werden:
Bz=2(Ec-Ea)/(Ec+Ea) (Gl. 1).
Hierbei sind Ec=∑cceq,c und Ea=∑aceq,a die Gesamtäquivaltenkonzentrationen der Kationen und der Anionen. Die Äquivalentkonzentration ceq,i berücksichtigt die Ladung der jeweiligen Ionen (ceq,i=|zi|∙mi). Die Molalität mi des jeweiligen Ions liegt in der Einheit mol/kg vor, zi ist die Ladung des jeweiligen Ions. Sind die Ergebnisse der analytischen Messungen in anderen Einheiten angegeben, muss zunächst eine Umrechnung erfolgen. [Steiger.etal:2012]Titel: Modelling the crystallization behaviour of mixed salt systems: input data requirements.
Autor / Verfasser: Steiger, M.; Heritage, A.
Im Betrag sollte Bz keine größere Abweichung als 0.05 bis 0.1 aufweisen. Größere Abweichungen deuten auf Fehler in der analytischen Bestimmung oder weitere, zunächst nicht bestimmte Ionen hin. Diese anderen Ionen wie Ammonium, Barium, Formiat oder Acetat können aufgrund von Umwelt- oder anthropogenen Einflüssen sowie vorherigen restauratorischen Eingriffen vorliegen, aber auch alkalische Baustoffe können ein Quelle für weitere Ionen sein.
Systematische Kationenüberschüsse, die bei abnehmenden Salzgehalten größer werden, können durch ein teilweises Anlösen von Calcit während der Extraktion der Baustoffproben entstehen, sofern Carbonat-haltige Materialien vorliegen. Dabei resultieren Ca2+- und HCO3--Ionen, von denen aber nur Ca2+-Ionen bestimmt werden. Der Calcium-Gehalt aus diesem Prozess kann aber maximal der Löslichkeit vom Calcit im Extraktionsverhältnis entsprechen. Die geringe Löslichkeit des Calcits ist hier also zu berücksichtigen. Zudem hat das indirekt ermittelte Calcit aus konservatorischer Sicht keine Relevanz, da es aufgrund seiner geringen Löslichkeit kein Salz ist, welches aktiv am Schädigungsprozess im Zuge der Salzkristallisation teilnimmt. Der maximal vertretbare Kationenüberschuss ergibt sich aus dem maximal möglichen Calcium-Gehalt und der analytischen Messungenauigkeit. Liegen trotz der Berücksichtigung der teilweisen Lösung von Calcit weitere Kationenüberschüsse vor, können weitere Carbonat- oder Bicarbonat-Gehalte aus besser löslichen Alkalicarbonaten vorliegen. Da Carbonat-Ionen im ECOS-Modell jedoch nicht berücksichtigt werden, kann ECOS in diesem Fall nicht für das vorliegende Salzgemisch verwendet werden. [Steiger.etal:2012]Titel: Modelling the crystallization behaviour of mixed salt systems: input data requirements.
Autor / Verfasser: Steiger, M.; Heritage, A.
Nicht nur die analytischen Verfahren können fehlerbehaftet sein, auch das thermodynamische Modell kann Fehlerquellen beinhalten [Steiger.etal:2008c]Titel: An improved model incorporating Pitzer's equations for calculation of thermodynamic properties of pore solutions implemented into an efficient program code
Autor / Verfasser: Steiger, Michael; Kiekbusch, Jana; Nicolai, Andreas . Im System MgSO4-H2O werden einige Umwandlungsbedingungen und Stabilitätsbereiche von Hydratphasen nicht korrekt angegeben [Bionda:2006]Titel: Modelling indoor climate and salt behaviour in historical buildings: A case study, Diss. Nr. 16567
. Im System MgSO4-H2O werden einige Umwandlungsbedingungen und Stabilitätsbereiche von Hydratphasen nicht korrekt angegeben [Bionda:2006]Titel: Modelling indoor climate and salt behaviour in historical buildings: A case study, Diss. Nr. 16567
Autor / Verfasser: Bionda, Davide . In einer mit dem Programm ermittelten Kristallisationsabfolge ist das Auftreten einer Magnesiumsulfat-Phase trotzdem richtig vorhergesagt, jedoch muss berücksichtigt werden, dass es sich bei der angegebenen Hydratstufe nicht zwingend um die richtige handelt. Um dies zu überprüfen, kann das Phasendiagramm des Systems hinzugezogen werden. [Steiger:2009a]Titel: Modellierung von Phasengleichgewichten
. In einer mit dem Programm ermittelten Kristallisationsabfolge ist das Auftreten einer Magnesiumsulfat-Phase trotzdem richtig vorhergesagt, jedoch muss berücksichtigt werden, dass es sich bei der angegebenen Hydratstufe nicht zwingend um die richtige handelt. Um dies zu überprüfen, kann das Phasendiagramm des Systems hinzugezogen werden. [Steiger:2009a]Titel: Modellierung von Phasengleichgewichten
Autor / Verfasser: Steiger, Michael
Ein weiterer wichtiger Aspekt, der bei dem Einsatz von ECOS-Runsalt zur Auswertung von Kristallisationsabfolgen berücksichtigt werden muss, ist, dass Gips im Programm nicht einbezogen wird. Der Grund dafür ist die sehr geringe Löslichkeit von Gips und von anderen, besser löslichen Salzen abweichende Schädigungsmechanismen. Die Vernachlässigung führt zu einer besseren Handhabbarkeit des Programms, da die Anzahl der benötigten Parameter reduziert werden kann. Gips stellt zwar eines der am häufigsten an Bauwerken vorkommenden Salze dar, hat jedoch eine sehr geringe Löslichkeit und eine hohe Deliqueszenzfeuchte. Kristallisiert Gips aus, ist es zunächst immobilisiert und eine Auflösung des Salzes ist nur durch Flüssigwassereintrag möglich. Folglich wird es durch klimatische Schwankungen kaum beeinflusst und sein Einfluss auf das Kristallisationsverhalten anderer Salze ist ebenfalls gering. Die Vernachlässigung des Salzes ist somit legitim, sofern sie sich nur auf seine Berücksichtigung in ECOS-Runsalt und nicht im Bereich der Objektschädigung bezieht. Die vom Gips resultierenden Sulfat- und Calcium-Ionen müssen vor der Eingabe der analytischen Daten in ECOS-Runsalt abgezogen werden. [Steiger.etal:2012]Titel: Modelling the crystallization behaviour of mixed salt systems: input data requirements.
Autor / Verfasser: Steiger, M.; Heritage, A.
Vorgehensweise zur Verwendung von ECOS:
- Analytische Bestimmung vorliegender Ionen.
- Bestimmung der Ladungsbilanz und Betrachtung der Ergebnisse hinsichtlich akzeptabler prozentualer Abweichungen. Es muss eine Abwägung erfolgen, ob die Abweichungen akzeptabel sind, so dass eine Korrektur der Ladungsbilanz erfolgen kann, oder ob auf die Verwendung von ECOS verzichtet werden muss. Bei Kationenüberschüssen ist gegebenenfalls das teilweise Lösen von Calcit zu betrachtet und nur die Calciumkonzentration zu korrigieren. [Steiger.etal:2012]Titel: Modelling the crystallization behaviour of mixed salt systems: input data requirements.
Autor / Verfasser: Steiger, M.; Heritage, A.
- Korrektur hinsichtlich Gips.
- Eingabe der korrigierten Ionen-Gehalte in ECOS.
- Eingabe einer festen Temperatur oder einer relativen Luftfeuchtigkeit sowie eines Bereichs der relativen Luftfeuchtigkeit beziehungsweise der Temperatur.
Liegt bei den eigegebenen Ionengehalten weiterhin eine unausgeglichene Ionenbilanz vor, gibt das Programm einen Hinweis darauf und bietet eine integrierte Autokorrekturfunktion an. Auf die Anwendung dieser sollte möglichst verzichtet werden, da hier eine proportionale Korrektur aller Anionen beziehungsweise aller Kationen vorgenommen wird. Die Überprüfung der Eingabedaten sollte manuell erfolgen. [Steiger.etal:2012]Titel: Modelling the crystallization behaviour of mixed salt systems: input data requirements.
Autor / Verfasser: Steiger, M.; Heritage, A. , [Steiger:2009a]Titel: Modellierung von Phasengleichgewichten
, [Steiger:2009a]Titel: Modellierung von Phasengleichgewichten
Autor / Verfasser: Steiger, Michael
Mit dem Programm ECOS-Runsalt ist es also möglich, die Kristallisationsabfolge in Abhängigkeit der relativen Luftfeuchtigkeit oder der Temperatur vorherzusagen, es müssen aber die Grenzen des mathematischen Modells und der analytischen Methoden sowie Fehlerquellen bei deren Interpretation berücksichtigt werden.
Literatur[Bearbeiten]
| [Arnold.etal:1991] | Arnold, Andreas; Zehnder, Konrad (1991): Monitoring Wall Paintings Affected by soluble Salts. In: Cather, Sharon (Hrsg.): The Conservation of Wall Paintings: Proceedings of a symposium organized by the Coutrauld Institut of Art and the Getty Conservation Institute, London, July 13-16, The Getty Conservation Institute, 103-136, Webadresse. |  |
| [Bionda:2006] | Bionda, Davide (2006): Modelling indoor climate and salt behaviour in historical buildings: A case study, Diss. Nr. 16567. Dissertation, ETH Zürich, Webadresse |  |
| [Price:2000] | European Commission. Directorate-General XII, Science, Research, Development (Hrsg.) Price, C. (2000): An expert chemical model for determining the environmental conditions needed to prevent salt damage in porous materials : protection and conservation of the European cultural heritage, Archetype Publications Ltd |  |
| [Steiger.etal:2008c] | Steiger, Michael; Kiekbusch, Jana; Nicolai, Andreas (2008): An improved model incorporating Pitzer's equations for calculation of thermodynamic properties of pore solutions implemented into an efficient program code. In: Construction and Building Materials, 22 (8), 1841-1850, Webadresse, https://doi.org/10.1016/j.conbuildmat.2007.04.020 |  |
| [Steiger.etal:2012] | Steiger, M.; Heritage, A. (2012): Modelling the crystallization behaviour of mixed salt systems: input data requirements.. In:: Proceedings of the 12th International Congress on the Deterioration and Conservation of Stone, October 22–26, 2012, New York, USA,. |  |
| [Steiger:2009a] | Steiger, Michael (2009): Modellierung von Phasengleichgewichten. In: Schwarz, Hans-Jürgen; Steiger, Michael (Hrsg.): Salzschäden an Kulturgütern: Stand des Wissens und Forschungsdefizite, Ergebnisse des DBU Workshops im Februar 2008 in Osnabrück, Deutsche Bundesstiftung Umwelt, Hannover, 80-99, Webadresse. |   |