Halit: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 6: | Zeile 6: | ||
{| align="right" style="border: 2px solid rgb(224, 224, 224); padding: 5px; width: 380px; background-color: rgb(249, 249, 249);" | {| align="right" style="border: 2px solid rgb(224, 224, 224); padding: 5px; width: 380px; background-color: rgb(249, 249, 249);" | ||
|- | |- | ||
| bgcolor="#cccccc" align="center" colspan="2" | '''{{#if: {{{minsalzbez|}}}|{{{minsalzbez}}}|{{PAGENAME}}}}'''<ref>http://webmineral.com/data/Halite.shtml gelesen 28.07.2010</ref><ref>http://www.mindat.org/min-1804.html<br> gelesen 28.07.2010</ref><ref>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral= | | bgcolor="#cccccc" align="center" colspan="2" | '''{{#if: {{{minsalzbez|}}}|{{{minsalzbez}}}|{{PAGENAME}}}}'''<ref>http://webmineral.com/data/Halite.shtml gelesen 28.07.2010</ref><ref>http://www.mindat.org/min-1804.html<br> gelesen 28.07.2010</ref><ref>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Halit gelesen 28.07.2010</ref> | ||
|- bgcolor="#dddddd" | |- bgcolor="#dddddd" | ||
| align="center" colspan="2" | [[Image:NaCl 27.4.2006-10x.JPG|300px]] | | align="center" colspan="2" | [[Image:NaCl 27.4.2006-10x.JPG|300px]] | ||
Version vom 19. Dezember 2010, 10:13 Uhr
<bibimport />
Autoren: Hans-Jürgen Schwarz, Nils Mainusch
zurück zu Chloride
| Halit[1][2][3] | |

| |
| Mineralogische Salzbezeichnung | Halit |
| Chemische Bezeichnung | Natriumchlorid |
| Trivialname | Kochsalz, Steinsalz |
| Chemische Formel | NaCl |
| Hydratformen | Natriumchlorid Dihydrat/Hydrohalit (NaCl•2H2O)[4] |
| Kristallklasse | kubisch |
| Deliqueszenzfeuchte 20°C | 75 % RH |
| Dichte (g/cm³) | 2,163 g/cm3 |
| Molvolumen | 27,02 cm3/mol |
| Molgewicht | 58,44 g/mol |
| Transparenz | durchsichtig bis durchscheinend |
| Spaltbarkeit | vollkommen |
| Kristallhabitus | kubische (würfelförmige) Kristalle; körnige, massige Aggregate |
| Zwillingsbildung | keine |
| Brechungsindices | nD=1,544 |
| Doppelbrechung | - |
| Optische Orientierung | isotrop |
| Pleochroismus | - |
| Dispersion | - |
| Phasenübergang | - |
| Chemisches Verhalten | leicht wasserlöslich |
| Bemerkungen | - |
Abstract[Bearbeiten]
Vorkommen von Halit[Bearbeiten]
Das gemeinhin als Speise- oder Streusalz verwendete Natriumchlorid wird auf dem Wege des bergmännischen Abbaus, der Gewinnung aus Meerwasser oder aus Salzseen nutzbar gemacht.
Der Gehalt an Natriumchlorid in Meerwasser liegt bei etwa 2,7 M.%.
Angaben zu Herkunft und Bildung von Halit an Baudenkmalen[Bearbeiten]
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumchlorid als Ausblühsalz entstehen. Anzuführen ist der hohe Gehalt von Natriumionen in Zementen. Der Eintrag von Natrium– und Chloridionen kann ferner durch belastetes Grund- und Oberflächenwasser erfolgen. Eine Fülle von Reinigungsmaterialien (wie Salzsäure, Abbeizprodukte) und v.a. früher verwendeten Restaurierungsmaterialien (wie Wasserglas) können Natrium – und Chloridionen in Baudenkmäler eintragen. Häufige Quelle für Halit ist ferner Streusalz, welches überwiegend aus Natriumchlorid besteht, und salzhaltiges Meerwasser bei Objekten in Küstennähe.
Lösungsverhalten[Bearbeiten]
Das in Norddeutschland häufig auftretende Halit zählt mit einer Löslichkeit von 358 g/l (20°C) zur Gruppe der leichtlöslichen und somit leicht mobilisierbaren Salzen. Die Löslichkeit verändert sich bei variierender Temperatur im Bereich 10-30°C vergleichsweise wenig.
| Temperatur | 10°C | 20°C | 40°C |
| Löslichkeit [g/l] | 356,5 | 358,8 | 364,2 |
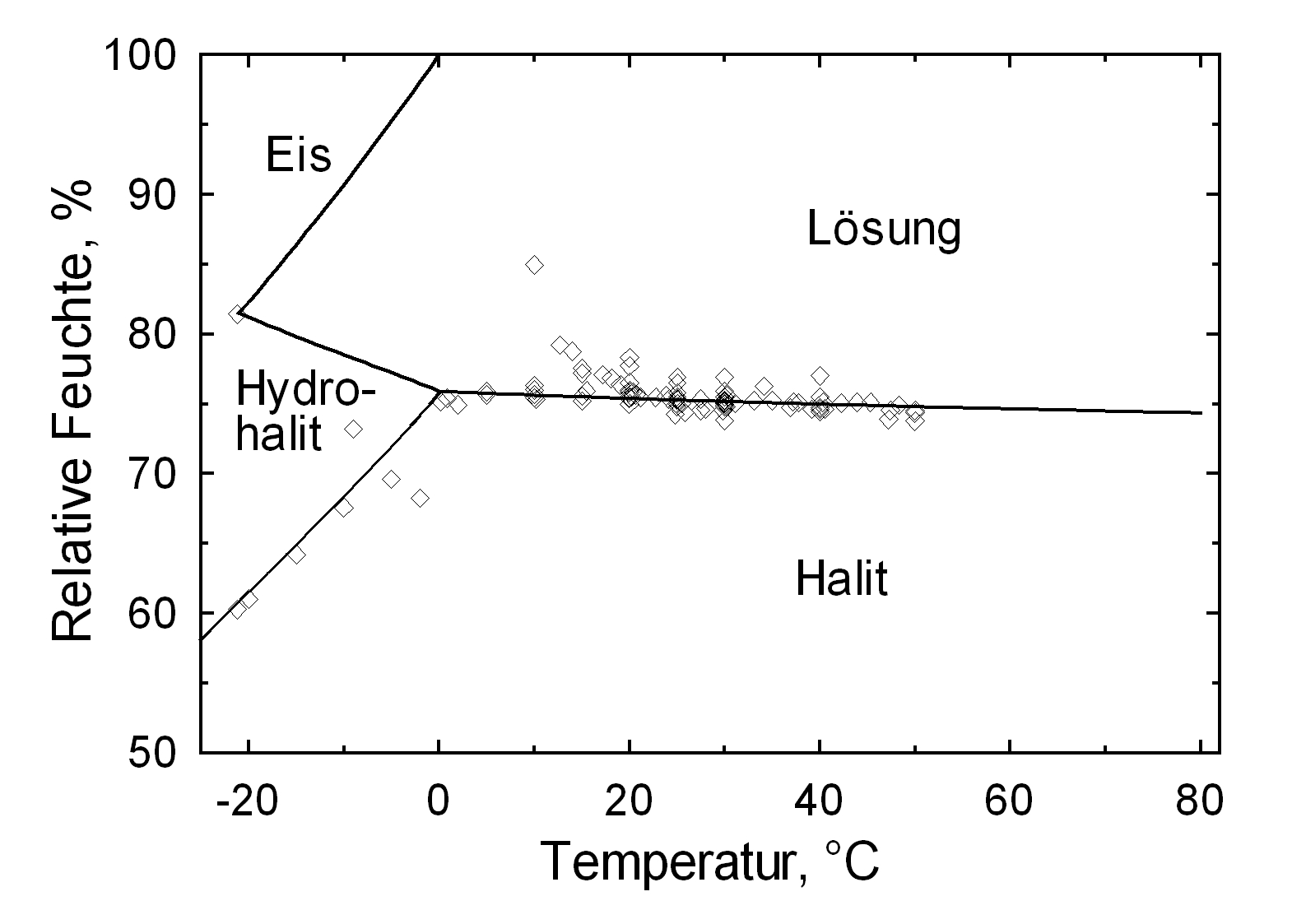
Hygroskopizität[Bearbeiten]
Die Deliqueszenzfeuchte von Halit liegt mit einem Wert von ca. 75% in einem Bereich, der bei nordeuropäischen Klimaverhältnissen häufig durchlaufen wird. Temperaturschwankungen beeinflussen den Deliqueszenzpunkt von Halit wenig, was unten im Vergleich mit Kaliumnitrat und Natrit veranschaulicht wird.
Feuchtesorption:
Theoretischen Berechnungen zufolge kann 1g NaCl 4,3g Feuchtigkeit aufnehmen. Nachstehend ist die Feuchtesorption bei variierenden relativen Feuchten wiedergegeben:
| Lagerungsfeuchte/Salzphase |
Nacl |
|---|---|
| 87% r.F. |
153 |
| 81% r.F. |
22 |
| 79% r.F. |
7 |
Kristallisationsdruck[Bearbeiten]
Bei der Kristallisation aus wässeriger Lösung lässt sich für Halit ein Kristallisationsdruck von 55,4-65,4 N/mm2 [Winkler:1975]Titel: Stone: Properties, Durability in Man ´s Environment
Autor / Verfasser: Winkler, Erhard M. angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm2). Zu berücksichtigen sind hierbei die vorliegenden Temperatur- und Konzentrationsverhältnisse, so dass die Zahlenwerte nur einen Hinweis auf ein reelles Schadenspotential in puncto Kristallisationsdruck des Salzes geben können. Im Vergleich zu anderen Salzphasen ist der Kristallisationsdruck extrem hoch.
angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm2). Zu berücksichtigen sind hierbei die vorliegenden Temperatur- und Konzentrationsverhältnisse, so dass die Zahlenwerte nur einen Hinweis auf ein reelles Schadenspotential in puncto Kristallisationsdruck des Salzes geben können. Im Vergleich zu anderen Salzphasen ist der Kristallisationsdruck extrem hoch.
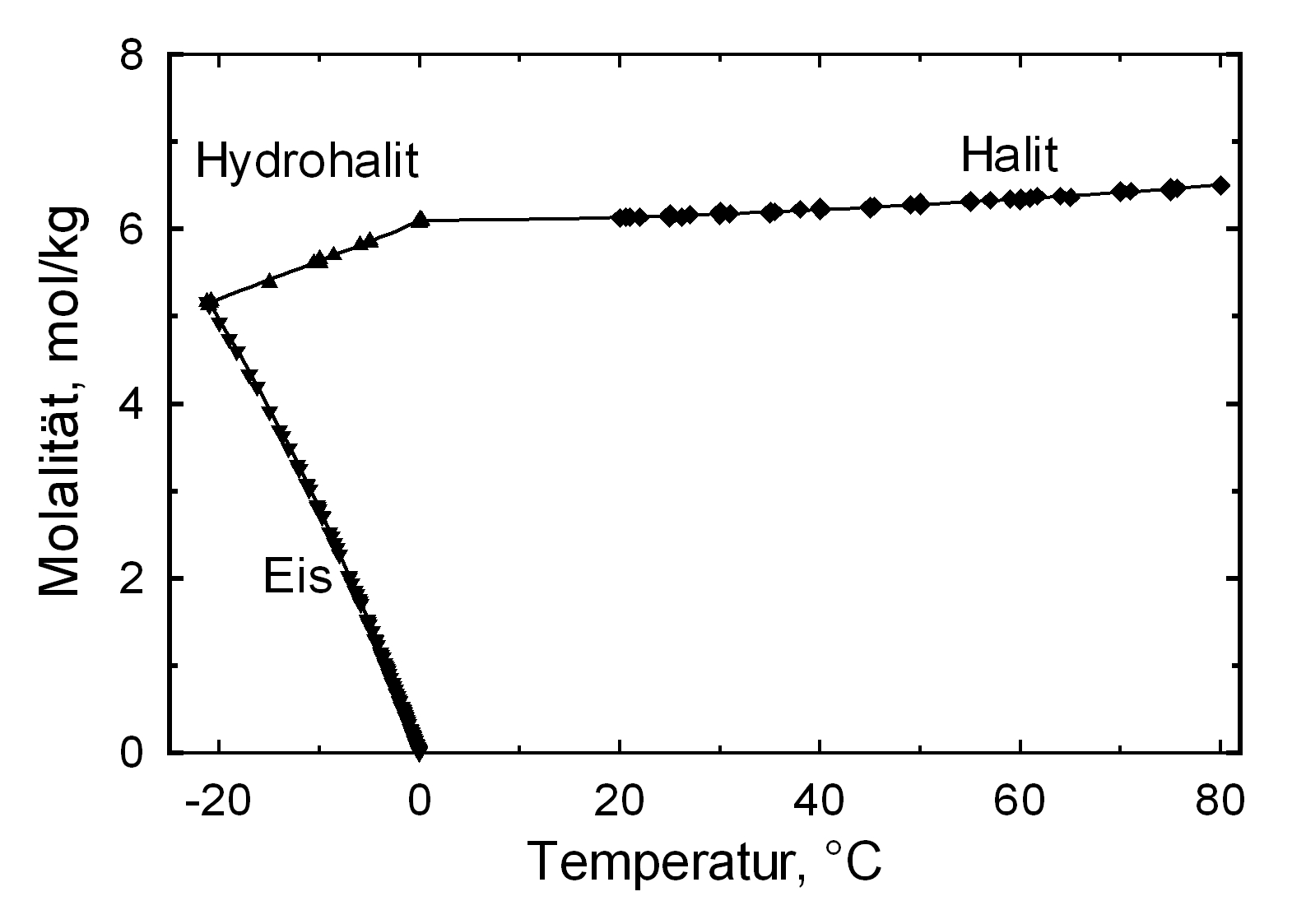
Hydratationsverhalten[Bearbeiten]
Unter normalen Bedingungen existiert nur die hydratwasserfreie Form des Salzes. Lediglich beim Ausfall aus einer gesättigten, wässerigen Natriumchloridlösung und einer Temperatur von unter 0,15 °C bildet sich als Bodensatz das Dihydrat Hydrohalit[5].
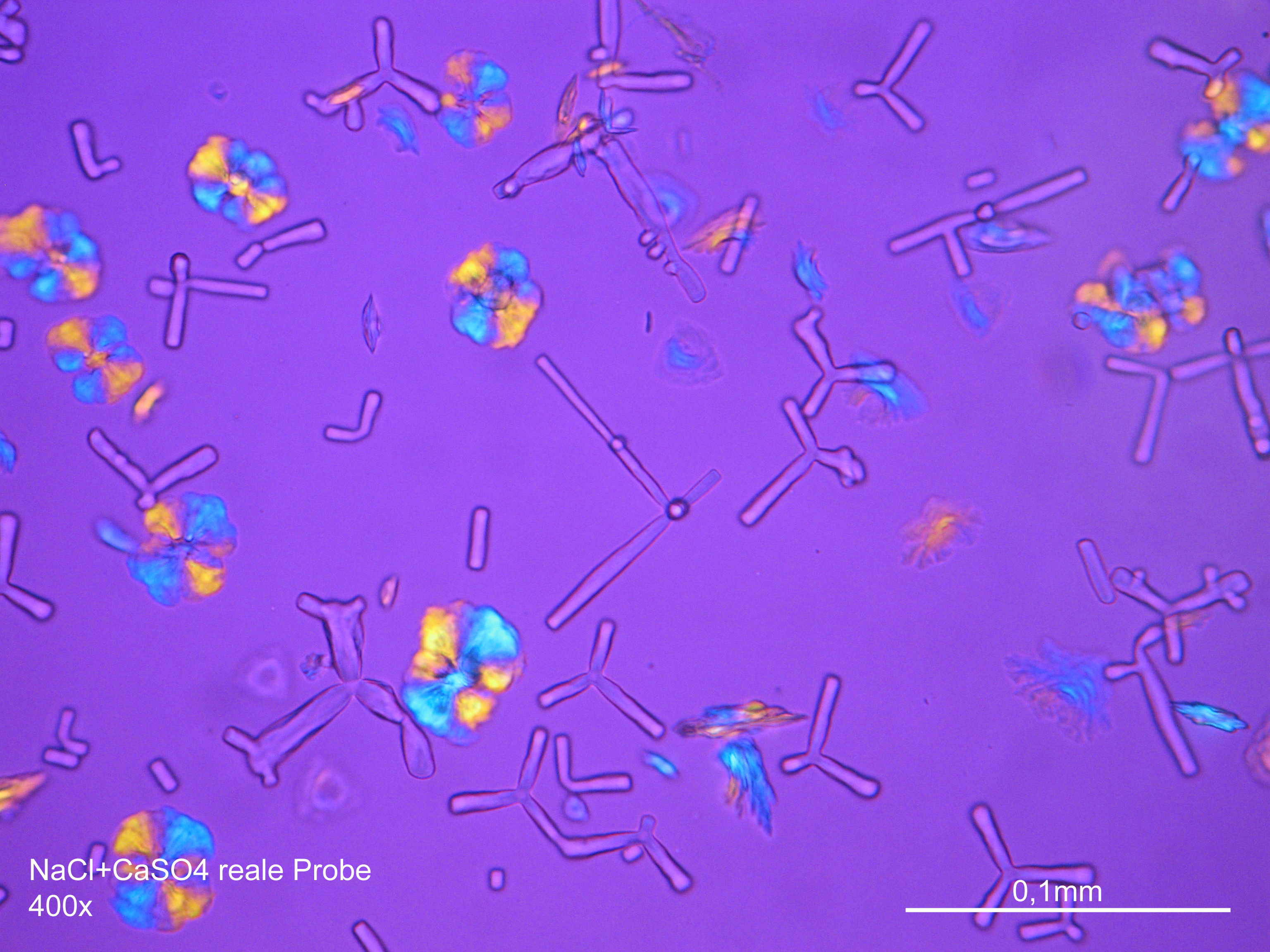
Mikroskopie[Bearbeiten]
Laboruntersuchung[Bearbeiten]
Natriumchloridkristalle sind mit großer Zuverlässigkeit anhand morphologischer Merkmale zu identifizieren. Einzelpartikel sind zumeist in Rechteck- oder in Würfelform/Oktaederform ausgebildet und weisen somit deutlich rechte Winkel im Kristallbau auf.
Brechungsindex: nD = 1,544
Kristallklasse: kubisch
Polarisationsmikroskopische Untersuchung:
Natriumchlorid zählt wie Kaliumchlorid zu den wenigen bauschädlichen Salzen des kubischen Kristallsystems. Der Kristall zeigt aufgrund seines isotropen inneren Aufbaus keine Eigenschaften der Doppelbrechung.
Die Zuweisung des Brechungsindex erfolgt entsprechend der Immersionsmethode in Standart- Immersionsöl mit einem Brechungsindex nD =1,518. Halitkristalle weisen in jeder möglichen Stellung die gleiche optische Dichte auf, wodurch es bei der Durchstrahlung von linear polarisiertem Licht zu keiner Geschwindigkeitsveränderung und Umorientierung der Lichtwellen kommt. Bei der Betrachtung mit gekreuzten Polarisatoren sind die Kristalle somit nicht erkennbar, sie verbleiben (richtungsunabhängig) ausgelöscht.
Verwechslungsmöglichkeiten:
Die Gruppe der isotropen bauschädlichen Salze beschränkt sich auf Halit, Sylvin und Fluorit; alle diese Phasen können problemlos voneinander unterschieden werden.
| Salzphase | Unterscheidungsmerkmale zu Calcit |
| Sylvin, KCl | Brechungsindex unter 1,518. |
| Fluorit, CaF2 | Brechungsindex unter 1,518, kaum wasserlöslich. |
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
- Auskristallisat aus wässrigen Proben auf Objektträger
Weblinks[Bearbeiten]
- ↑ http://webmineral.com/data/Halite.shtml gelesen 28.07.2010
- ↑ http://www.mindat.org/min-1804.html
gelesen 28.07.2010 - ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Halit gelesen 28.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Hydrohalit gelesen 28.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Hydrohalit gelesen 28.07.2010
Literatur[Bearbeiten]
[Filter fehlt]