Natriumsulfat-Heptahydrat: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
|||
| Zeile 66: | Zeile 66: | ||
<br clear=all> | <br clear=all> | ||
==Die Rolle | ==Die Rolle des Heptahydrats im Schädigungsprozess== | ||
siehe <bib id="Saidov:2012"/> | siehe <bib id="Saidov:2012"/> | ||
Version vom 7. Mai 2015, 14:19 Uhr
Autor: Amelie Stahlbuhk
zurück zu Sulfate
| Natriumsulfat-Heptahydrat | |
| Mineralogische Salzbezeichnung | |
| Chemische Bezeichnung | Natriumsulfat-Heptahydrat |
| Trivialname | |
| Chemische Formel | Na2SO4•7H2O |
| Hydratformen | Na2SO4•10H2O (Mirabilit) |
| Kristallsystem | |
| Deliqueszenzfeuchte 20°C | 89,1 % |
| Löslichkeit(g/l) bei 20°C | 3,143 mol/kg |
| Dichte (g/cm³) | |
| Molares Volumen | |
| Molare Masse | 268,14 g/mol |
| Transparenz | |
| Spaltbarkeit | |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | |
| Kristalloptik | |
| Brechungsindices | |
| Doppelbrechung | |
| Optische Orientierung | |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
| [Steiger.etal:2008]Titel: Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress Autor / Verfasser: Steiger, Michael; Asmussen, Sönke 
| |
Einleitung[Bearbeiten]
Natriumsulfat-Heptahydrat ist eine metastabile Hydratform des Natriumsulfats. Es kann bei der schnellen Kühlung einer Lösung entstehen, die bei 40 °C gesättigt ist [Gans:1978]Titel: Thermodynamic stability of sodium sulfate heptahydrate
Autor / Verfasser: Gans W. .
.
Löslichkeit[Bearbeiten]
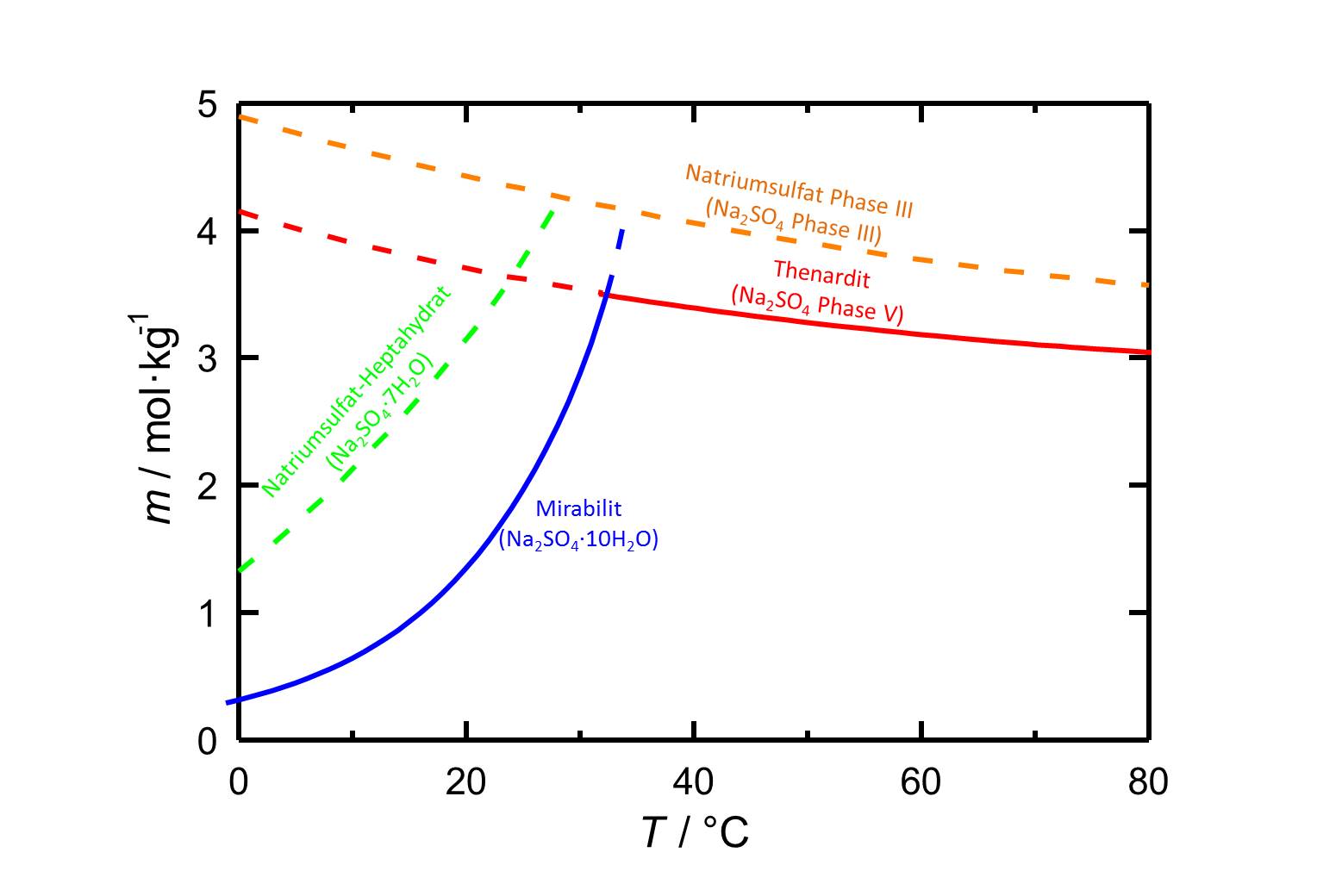
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke
 .
.
Die Löslichkeit des Natriumsulfat-Heptahydrats liegt bei 20 °C bei 3,143 mol/kg [Steiger.etal:2008]Titel: Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke . Aus Abbildung 1 geht hervor, dass diese Hydratform, auch wennn sie stets metastabil ist, eher bei niedrigeren Temperaturen relevant ist.
. Aus Abbildung 1 geht hervor, dass diese Hydratform, auch wennn sie stets metastabil ist, eher bei niedrigeren Temperaturen relevant ist.
Hygroskopizität[Bearbeiten]
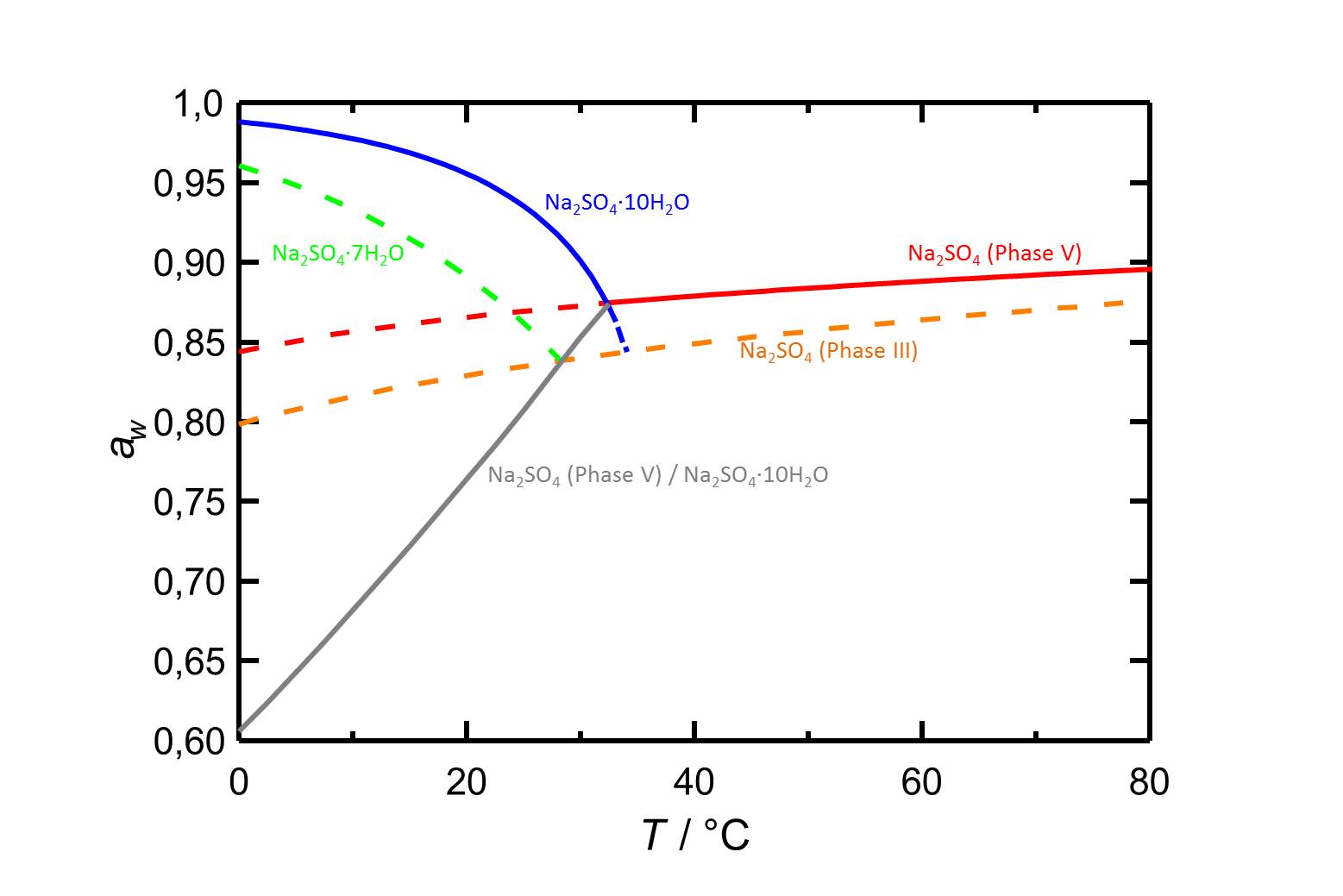
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke

Bei 20 °C weist das Heptahydrat eine Deliqueszenzfeuchte von 89,1 % auf. Bei steigender Temperatur nimmt die Deliqueszenzfeuchte höhere Werte an (s. Tabelle 1).
| 0°C | 10°C | 20°C |
| 96,1%r.F. | 93,3%r.F. | 89,1%r.F. |
Die Rolle des Heptahydrats im Schädigungsprozess[Bearbeiten]
siehe [Saidov:2012]Titel: Sodium sulfate heptahydrate in weathering phenomena of porous materials
Autor / Verfasser: Saidov, Tamerlan
Weblinks[Bearbeiten]
Literatur[Bearbeiten]
| [Gans:1978] | Gans W. (1978): Thermodynamic stability of sodium sulfate heptahydrate. In: Z. Phys. Chem. NF, 111 (1), 39-46, Webadresse |  |
| [Saidov:2012] | Saidov, Tamerlan (2012): Sodium sulfate heptahydrate in weathering phenomena of porous materials. Dissertation, Eindhoven: Technische Universiteit Eindhoven, Webadresse |  |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Webadresse, https://doi.org/10.1016/j.gca.2008.05.053 |  |