Nitrocalcit: Unterschied zwischen den Versionen
Zur Navigation springen
Zur Suche springen
Weblinks
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (Eine dazwischenliegende Version von einem anderen Benutzer wird nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
<br> Autoren: Hans-Jürgen [[Benutzer:Hschwarz|Schwarz]] | <br> Autoren: Hans-Jürgen [[Benutzer:Hschwarz|Schwarz]] | ||
<br> zurück zu [[Nitrate]] | <br> zurück zu [[Nitrate]] | ||
| Zeile 68: | Zeile 68: | ||
--> | --> | ||
== | == Löslichkeit == | ||
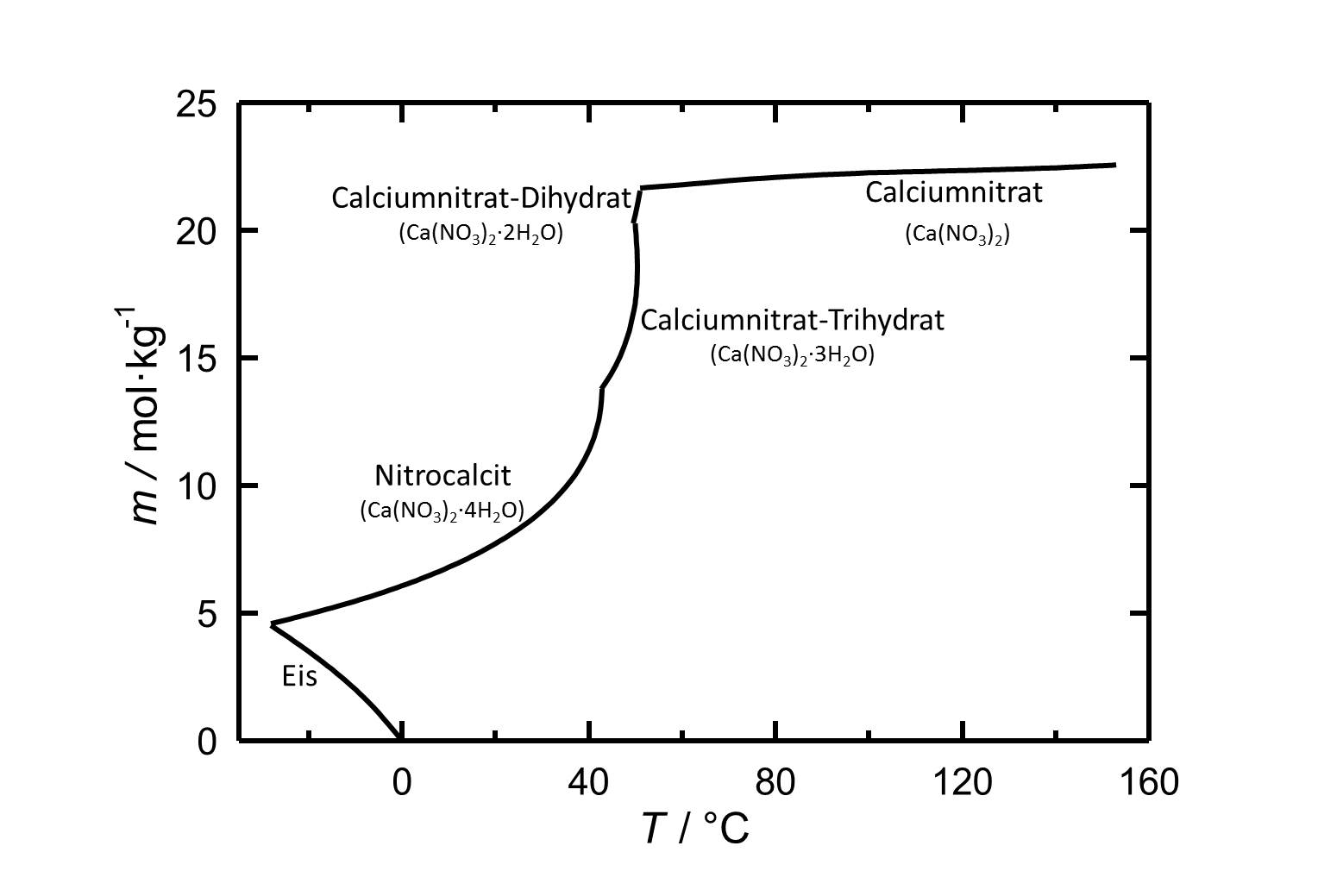
[[Datei: | [[Datei:Loeslichkeit von Calciumnitrat in Wasser.jpg|thumb|800px|left|'''Abbildung 1''': Löslichkeit von Calciumnitrat in Wasser. Aufgetragen ist die Molalität ''m'' [n(Ca(NO<sub>3</sub>)<sub>2</sub>•xH<sub>2</sub>O)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur.]] | ||
<br clear=all> | |||
Nitrocalcit ist die bei 20°C stabile Phase von Calciumnitrat und weist eine hohe Löslichkeit in Wasser auf. | |||
<br clear=all> | |||
==Hygroskopizität== | |||
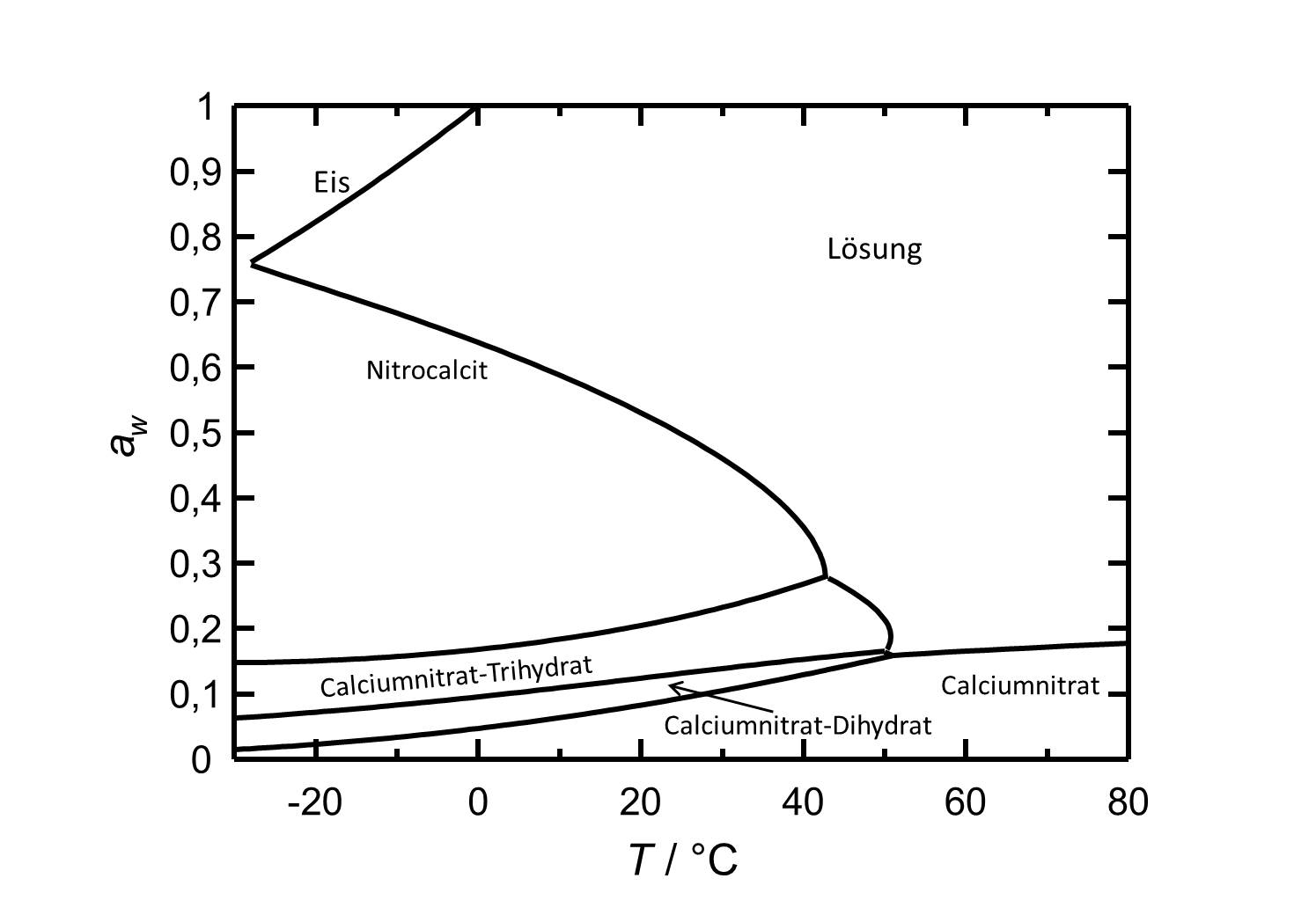
[[Datei:Del Ca(NO3)2 d.jpg|thumb|800px|left|'''Abbildung 2''': Deliqueszenzverhalten von Calciumnitrat in Abhängigkeit der Temperatur. Aufgetragen ist die Wasseraktivität ''a<sub>w</sub>'' gegen die Temperatur.]] | |||
<br clear=all> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Table 1: Deliqueszenzfeuchten von Nitrocalcit bei verschiedenen runden Temperaturen <bib id="Steiger.etal:2014"/>''. | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| 0°C | |||
|bgcolor = "#F0F0F0" align=center| 10°C | |||
|bgcolor = "#F0F0F0" align=center| 20°C | |||
|bgcolor = "#F0F0F0" align=center| 30°C | |||
|bgcolor = "#F0F0F0" align=center| 40°C | |||
|bgcolor = "#F0F0F0" align=center| 50°C | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| 63,8%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 58,8%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 53,1%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 46,0%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 35,5%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 21,3%r.F. (Ca(NO<sub>3</sub>)<sub>2</sub>•3H<sub>2</sub>O) | |||
|} | |||
<br clear=all> | <br clear=all> | ||
Version vom 20. März 2015, 07:19 Uhr
Autoren: Hans-Jürgen Schwarz
zurück zu Nitrate
| Nitrocalcit[1][2] | |

| |
| Mineralogische Salzbezeichnung | Nitrocalcit |
| Chemische Bezeichnung | Calciumnitrat Tetrahydrat |
| Trivialname | |
| Chemische Formel | Ca(NO3)2•4H2O |
| Hydratformen | Ca(NO3)2•2H2O (Calciumnitrat-Dihydrat) Ca(NO3)2•3H2O (Calciumnitrat-Trihydrat) |
| Kristallsystem | monoklin |
| Deliqueszenzfeuchte 20°C | 53,06 % |
| Löslichkeit(g/l) bei 20°C | 7,726 mol/kg |
| Dichte (g/cm³) | 1,82 g/cm3 |
| Molares Volumen | 129,8 cm3/mol |
| Molare Masse | 236,15 g/mol |
| Transparenz | |
| Spaltbarkeit | |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | |
| Kristalloptik | |
| Brechungsindices | nx = 1,465 ny = 1,498 nz = 1,504 |
| Doppelbrechung | Δ = 0,039 |
| Optische Orientierung | negativ |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
| [Broul.etal:1981]Titel: Solubility in organic two component systems Autor / Verfasser: Broul M., Nyvlt J.; Soehnel O. 
| |
Abstract[Bearbeiten]
Das Salz Nitrocalcit wird vorgestellt, seine Eigenschaften und Möglichkeiten es nachzuweisen beschrieben und in Fotos dokumentiert.
Löslichkeit[Bearbeiten]
Nitrocalcit ist die bei 20°C stabile Phase von Calciumnitrat und weist eine hohe Löslichkeit in Wasser auf.
Hygroskopizität[Bearbeiten]
| 0°C | 10°C | 20°C | 30°C | 40°C | 50°C |
| 63,8%r.F. | 58,8%r.F. | 53,1%r.F. | 46,0%r.F. | 35,5%r.F. | 21,3%r.F. (Ca(NO3)2•3H2O) |
Unter dem Polarisationsmikrokop[Bearbeiten]
- Aus gesättigter Lösung unter Zugabe von Ethanol auskristallisiert
- In der Mikroklimakammer auskristallisiert
Weblinks
[Bearbeiten]
- ↑ http://www.mindat.org/min-2919.html gesehen 29.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Nitrocalcit gesehen 29.07.2010
Literatur[Bearbeiten]
| [Broul.etal:1981] | Elsevier (Hrsg.) Broul M., Nyvlt J.; Soehnel O. (1981): Solubility in organic two component systems, Elsevier |  |
| [Steiger.etal:2014] | Steiger, Michael; Charola A. Elena; Sterflinger, Katja (2014): Weathering and Deterioration. In: Siegesmund S.; Snethlage R. (Hrsg.): Stone in Architecture, Springer Verlag Berlin Heidelberg, 223-316, Webadresse, https://doi.org/10.1007/978-3-642-45155-3_4. |  |