Test
Autoren: Hans-Jürgen Schwarz, Nils Mainusch
zurück zu Chloride
| Test[1][2][3][4] | |

| |
| Mineralogische Salzbezeichnung | Halit |
| Chemische Bezeichnung | Natriumchlorid |
| Trivialname | Kochsalz, Steinsalz |
| Chemische Formel | NaCl |
| Hydratformen | Natriumchlorid Dihydrat/Hydrohalit (NaCl•2H2O) |
| Kristallsystem | kubisch |
| Deliqueszenzfeuchte 20°C | 75,4% |
| Löslichkeit(g/l) bei 20°C | 358 g/l |
| Dichte (g/cm³) | 2,163 g/cm3 |
| Molares Volumen | 27,02 cm3/mol |
| Molare Masse | 58,44 g/mol |
| Transparenz | durchsichtig bis durchscheinend |
| Spaltbarkeit | vollkommen |
| Kristallhabitus | kubische (würfelförmige) Kristalle; körnige, massige Aggregate |
| Zwillingsbildung | keine |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | leicht wasserlöslich |
| Kristalloptik | |
| Brechungsindices | nD=1,544 |
| Doppelbrechung | |
| Optische Orientierung | isotrop |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
| [Steiger.etal:2014]Titel: Weathering and Deterioration Autor / Verfasser: Steiger, Michael; Charola A. Elena; Sterflinger, Katja 
| |
Abstract[Bearbeiten]
Vorkommen von Halit[Bearbeiten]
Das gemeinhin als Speise- oder Streusalz verwendete Natriumchlorid wird auf dem Wege des bergmännischen Abbaus, der Gewinnung aus Meerwasser oder aus Salzseen nutzbar gemacht.
Der Gehalt an Natriumchlorid in Meerwasser liegt bei etwa 2,7 M.%.
Angaben zu Herkunft und Bildung von Halit an Baudenkmalen[Bearbeiten]
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumchlorid als Ausblühsalz entstehen. Anzuführen ist der hohe Gehalt von Natriumionen in Zementen. Der Eintrag von Natrium– und Chloridionen kann ferner durch belastetes Grund- und Oberflächenwasser erfolgen. Eine Fülle von Reinigungsmaterialien (wie Salzsäure, Abbeizprodukte) und v.a. früher verwendeten Restaurierungsmaterialien (wie Wasserglas) können Natrium – und Chloridionen in Baudenkmäler eintragen. Häufige Quelle für Halit ist ferner Streusalz, welches überwiegend aus Natriumchlorid besteht, und salzhaltiges Meerwasser bei Objekten in Küstennähe.
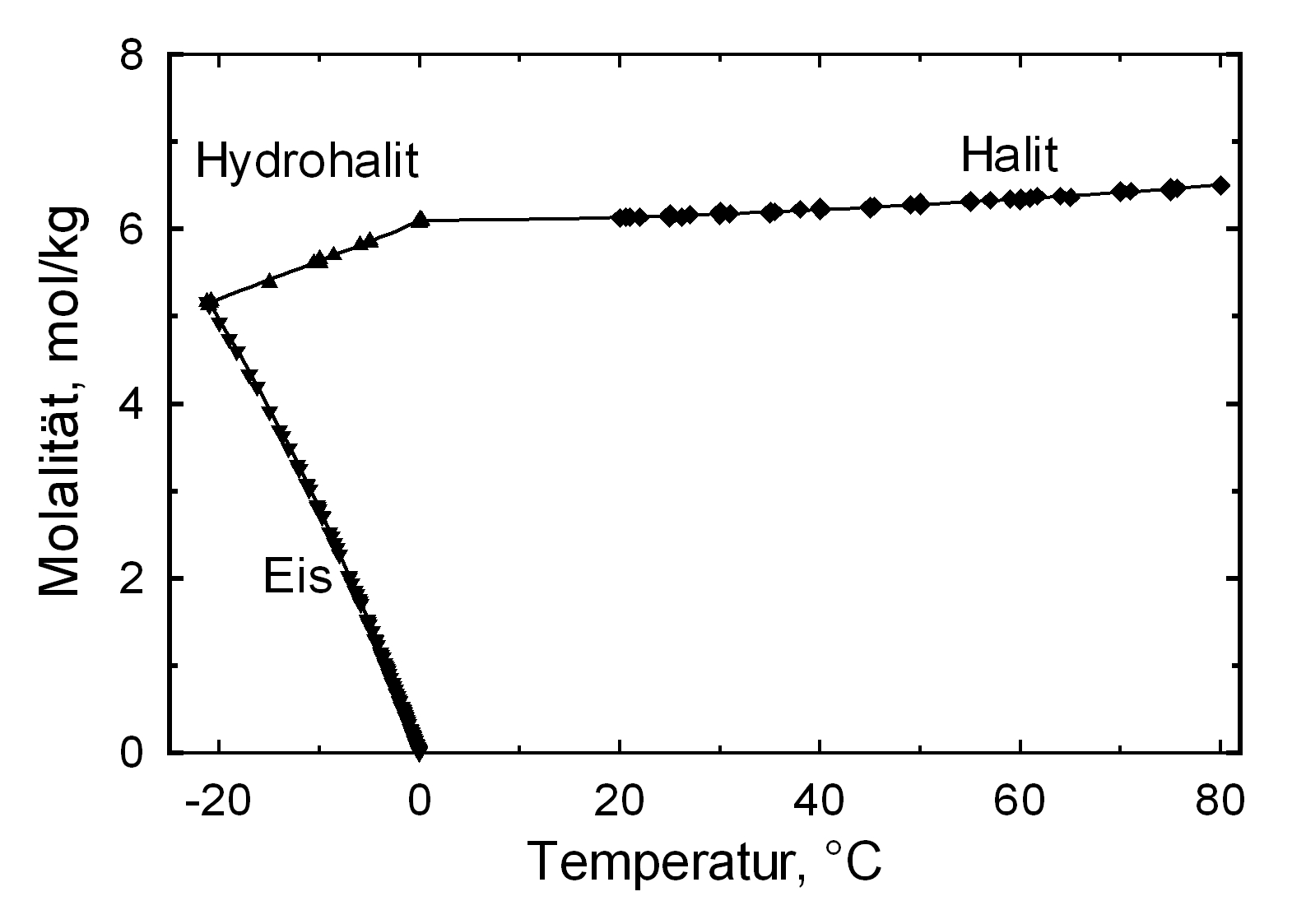
Lösungsverhalten[Bearbeiten]
Der häufig auftretende Halit zählt mit einer Löslichkeit von 358 g/l (20°C) zur Gruppe der leichtlöslichen und somit leicht mobilisierbaren Salzen. Die Löslichkeit verändert sich bei variierender Temperatur im Bereich 10-30°C vergleichsweise wenig.
| Temperatur | 10°C | 20°C | 40°C |
| Löslichkeit [g/l] | 356,5 | 358,8 | 364,2 |
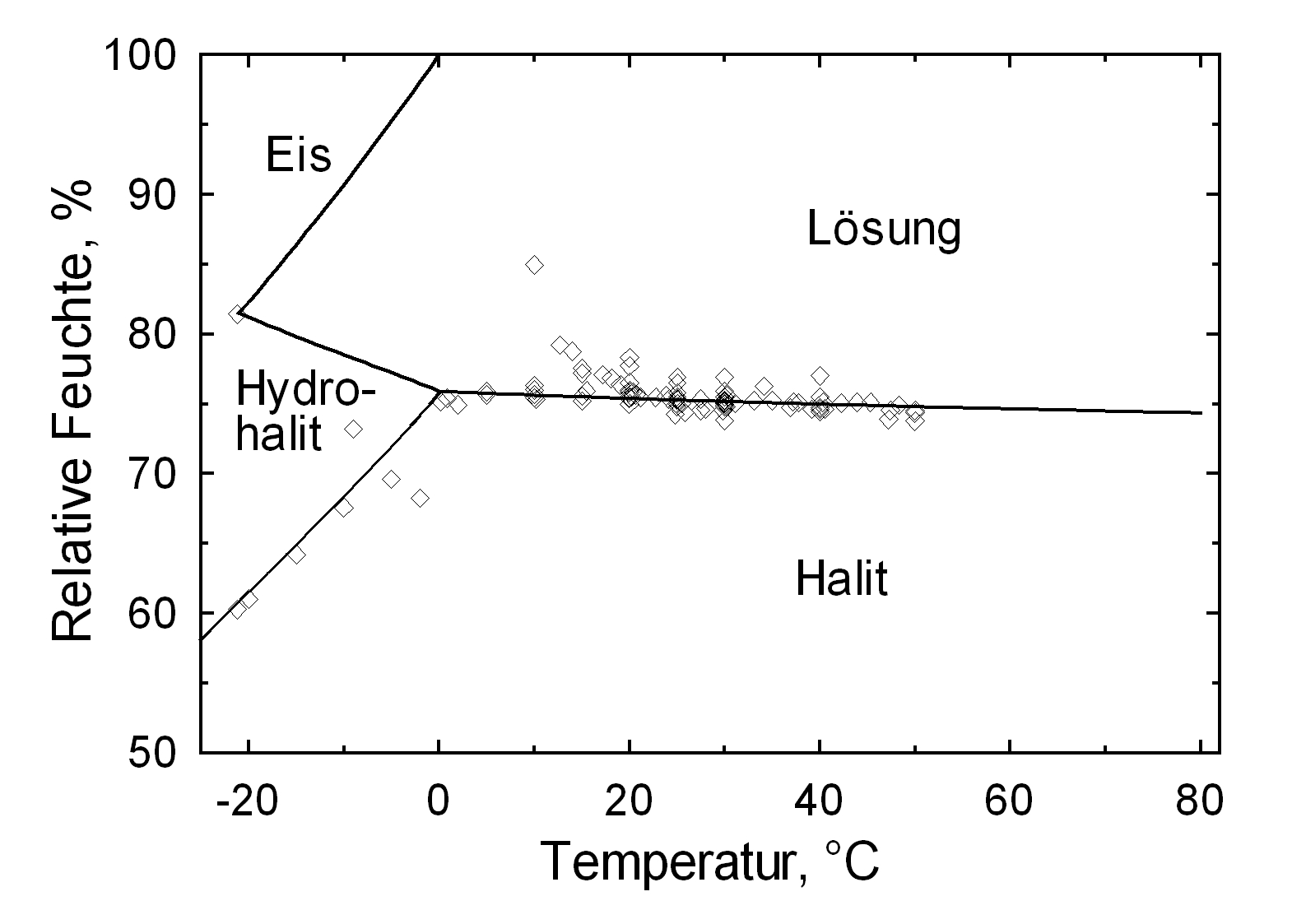
Hygroskopizität[Bearbeiten]
Die Deliqueszenzfeuchte von Halit liegt mit einem Wert von ca. 75% in einem Bereich, der bei nordeuropäischen Klimaverhältnissen häufig durchlaufen wird. Temperaturschwankungen beeinflussen den Deliqueszenzpunkt von Halit wenig, was unten im Vergleich mit Kaliumnitrat und Natrit veranschaulicht wird.
| 0°C | 10°C | 20°C | 30°C | 40°C | 50°C |
| 75,9%r.F. | 75,6%r.F. | 75,4%r.F. | 75,2%r.F. | 75,0%r.F. | 74,8%r.F. |
Feuchtesorption:
Theoretischen Berechnungen zufolge kann 1g NaCl 4,3g Feuchtigkeit aufnehmen. Nachstehend ist die Feuchtesorption bei variierenden relativen Feuchten wiedergegeben:
| Lagerungsfeuchte/Salzphase | NaCl |
| 87% r.F. | 153 |
| 81% r.F. | 22 |
| 79% r.F. | 7 |
Kristallisationsdruck[Bearbeiten]
Bei der Kristallisation aus wässeriger Lösung lässt sich für Halit ein Kristallisationsdruck von 55,4-65,4 N/mm2 [Winkler:1975]Titel: Stone: Properties, Durability in Man ´s Environment
Autor / Verfasser: Winkler, Erhard M. angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm2). Zu berücksichtigen sind hierbei die vorliegenden Temperatur- und Konzentrationsverhältnisse, so dass die Zahlenwerte nur einen Hinweis auf ein reelles Schadenspotential in puncto Kristallisationsdruck des Salzes geben können. Im Vergleich zu anderen Salzphasen ist der Kristallisationsdruck extrem hoch.
angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm2). Zu berücksichtigen sind hierbei die vorliegenden Temperatur- und Konzentrationsverhältnisse, so dass die Zahlenwerte nur einen Hinweis auf ein reelles Schadenspotential in puncto Kristallisationsdruck des Salzes geben können. Im Vergleich zu anderen Salzphasen ist der Kristallisationsdruck extrem hoch.
Hydratationsverhalten[Bearbeiten]
Unter normalen Bedingungen existiert nur die hydratwasserfreie Form des Salzes. Lediglich beim Ausfall aus einer gesättigten, wässerigen Natriumchloridlösung und einer Temperatur von unter 0,15 °C bildet sich als Bodensatz das Dihydrat Hydrohalit [4].
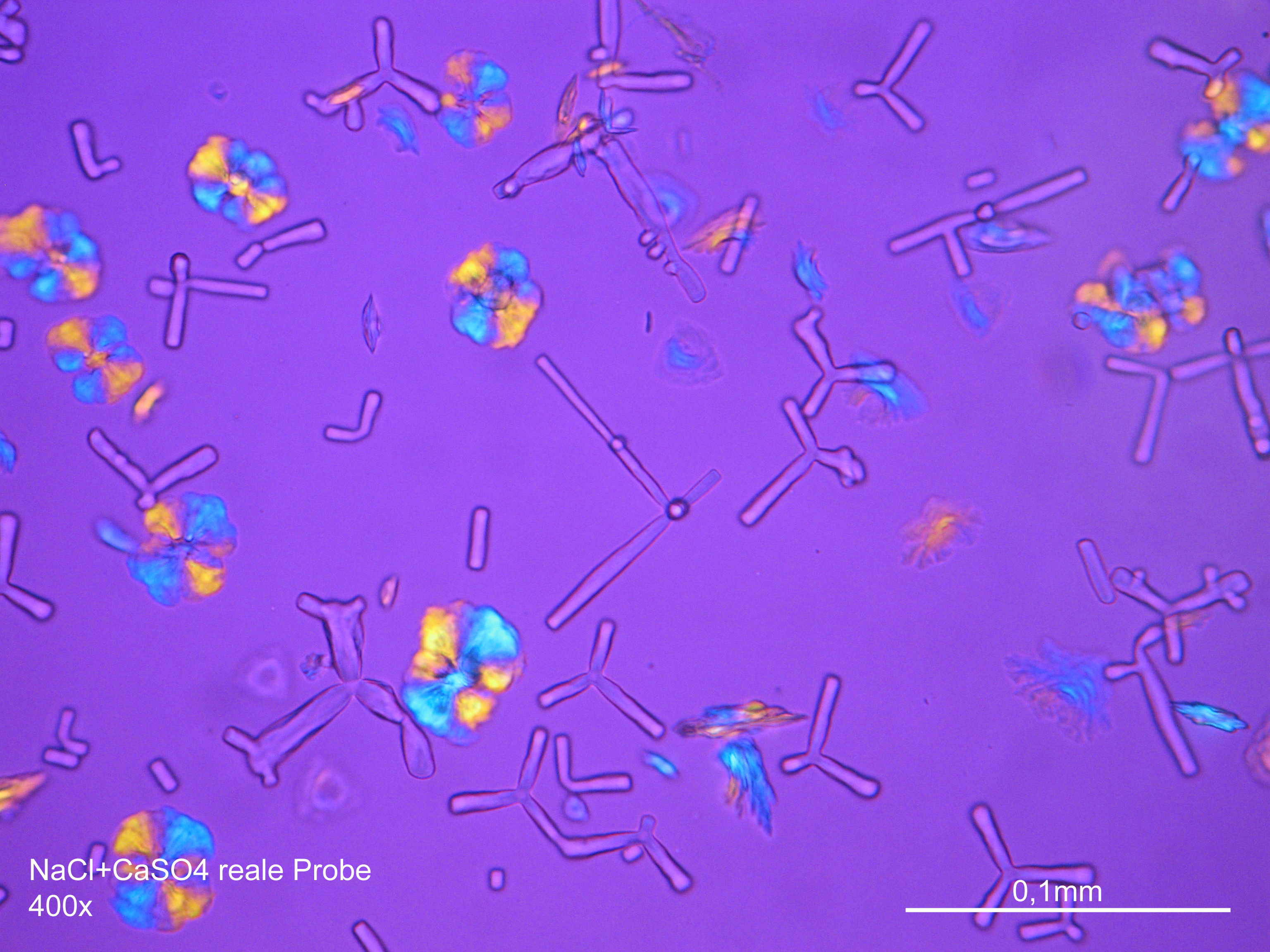
Mikroskopie[Bearbeiten]
Laboruntersuchung[Bearbeiten]
Natriumchloridkristalle sind mit großer Zuverlässigkeit anhand morphologischer Merkmale zu identifizieren. Einzelpartikel sind zumeist in Rechteck- oder in Würfelform/Oktaederform ausgebildet und weisen somit deutlich rechte Winkel im Kristallbau auf.
Brechungsindex: nD = 1,544
Kristallklasse: kubisch
Polarisationsmikroskopische Untersuchung:
Natriumchlorid zählt wie Kaliumchlorid zu den wenigen bauschädlichen Salzen des kubischen Kristallsystems. Der Kristall zeigt aufgrund seines isotropen inneren Aufbaus keine Eigenschaften der Doppelbrechung.
Die Zuweisung des Brechungsindex erfolgt entsprechend der Immersionsmethode in Standart- Immersionsöl mit einem Brechungsindex nD =1,518. Halitkristalle weisen in jeder möglichen Stellung die gleiche optische Dichte auf, wodurch es bei der Durchstrahlung von linear polarisiertem Licht zu keiner Geschwindigkeitsveränderung und Umorientierung der Lichtwellen kommt. Bei der Betrachtung mit gekreuzten Polarisatoren sind die Kristalle somit nicht erkennbar, sie verbleiben (richtungsunabhängig) ausgelöscht.
Verwechslungsmöglichkeiten:
Die Gruppe der isotropen bauschädlichen Salze beschränkt sich auf Halit, Sylvin und Fluorit; alle diese Phasen können problemlos voneinander unterschieden werden.
| Salzphase | Unterscheidungsmerkmale |
| Sylvin KCl | Brechungsindex unter 1,518. |
| Fluorit CaF2 | Brechungsindex unter 1,518, kaum wasserlöslich. |
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
- Auskristallisat aus wässrigen Proben auf Objektträger
Weblinks[Bearbeiten]
- ↑ http://webmineral.com/data/Halite.shtml gelesen 28.07.2010
- ↑ http://www.mindat.org/min-1804.html gelesen 28.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Halit gelesen 28.07.2010
- ↑ 4,0 4,1 http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Hydrohalit gelesen 28.07.2010
Literatur[Bearbeiten]
| [DAns:1933] | d'Ans, J. (1933): Die Lösungsgleichgewichte der Systeme der Salze ozeanischer Salzablagerungen, Verlagsgesellschaft für Ackerbau, M.B.H. Berlin |  |
| [Stark.etal:1996] | Stark, Jochen; Stürmer, Sylvia (1996): Bauschädliche Salze, Bauhaus-Univ. Weimar |  |
| [Steiger.etal:2014] | Steiger, Michael; Charola A. Elena; Sterflinger, Katja (2014): Weathering and Deterioration. In: Siegesmund S.; Snethlage R. (Hrsg.): Stone in Architecture, Springer Verlag Berlin Heidelberg, 223-316, Webadresse, https://doi.org/10.1007/978-3-642-45155-3_4. |  |
| [Vogt.etal:1993] | Vogt, R.; Goretzki, Lothar (1993): Der Einfluss hygroskopischer Salze auf die Gleichgewichtsfeuchte und Trocknung anorganischer Baustoffe, unveröffentlichter Bericht. |  |
| [Winkler:1975] | Winkler, Erhard M. (1975): Stone: Properties, Durability in Man ´s Environment, Springer Verlag, Wien |  |
Weitere Literatur
| [Biscontin.etal:1988] | Biscontin, G.; Driussi, G.; Masin, A.; Zendri, E. (1988): Study on stones artificially salted with MgSO4•7H2O and NaCl and treated with siliconic resin. In: Ciabach, J. (Hrsg.): Proceedings of the 6th International Congress on Deterioration and Conservation of Stone,Nicholas Copernicus University 194-206. |  |
| [Brown.etal:2000] | Brown, P. W.; Badger, S. (2000): The distributions of bound sulfates and chlorides in concrete subjected to mixed NaCl, MgSO4, Na2SO4 attack. In: Cem. Concr. Res., 30 (10), 1535-1542 |  |
| [Brown.etal:2001] | Brown, P. W.; Badger, S. (2001): Reply to the discussion by William G. Hime and Stella L. Marusin of the paper "The distribution of bound sulfates and chlorides in concrete to mixed NaCl, MgSO4, Na2SO4 attack". In: Cem. Concr. Res., 31 (7), 1117-1118 |  |
| [Desarnaud.etal:2014a] | Desarnaud, J.; Derluyn, H.; Carmeliet, J.; Bonn, D.; Shahidzadeh, N. (2014): Metastability limit for the nucleation of NaCl crystals in confinement,. In: Journal of Physical Chemistry Letters, 5 (5), 890-895, https://doi.org/10.1021/jz500090x |  |
| [Dorn.etal:2007] | Dorn, Joachim; Steiger, Michael (2007): Measurement and Calculation of Solubilities in the Ternary System NaCH3COO + NaCl + H2O from 278 K to 323 K. In: Journal of Chemical and Engineering Data, 5 (52), 1784-1790, 10.1021/je7001495 |  |
| [Friedel:1978] | Friedel, B. (1978): Gipslöslichkeiten in wässerigen Systemen mit NaCl, MgCl2, Na2SO4 und MgSO4. In: Zeitschrift für Pflanzenernährung und Bodenkunde, 141 (3), 337-346, 10.1002/jpln.19781410309 |  |
| [Glasner.etal:1974] | Glasner, A.; Zidon, M. (1974): The crystallization of NaCl in the presence of (Fe(CN)6)4- ions. In: Journal of Crystal Growth, 21 (2), 294-304, 10.1016/0022-0248(74)90018-9 |  |
| [Godts.etal:2021a] | Godts, S.; Orr, S.A.; Desarnaud, J.; Steiger, M.; Wilhelm, K.; De Clercq, H.; Cnudde, V.; De Kock, T. (2021): NaCl-related weathering of stone: the importance of kinetics and salt mixtures in environmental risk assessment. In: Heritage Science, 9 (44), Webadresse |  |
| [Granneman.etal:2019] | Granneman, S.J.C.; Lubelli, B.; van Hees, R.P.J. (2019): Effect of mixed in crystallization modifiers on the resistance of lime mortar against NaCl and Na2SO4 crystallization. In: Construction and Building Materials , 194 (), 62-70, Webadresse |  |
| [Knox.etal:1975] | Knox, R.; Shlichta, P. (1975): Growth band studies of halite (NaCl) crystallization in brine ponds and saline evaporite deposits. In:: ACCG III, 3rd amer. Conf. Crystal Growth,, 139-140. |  |
| [Linnow.etal:2007c] | Linnow, Kirsten; Juling, Herbert; Steiger, Michael (2007): Investigation of NaCl deliquescence in porous substrates using RH-XRD. In: Environmental Geology, 52 (2), 317-327, 10.1007/s00254-006-0590-9 |  |
| [Lubelli.etal:2006] | Lubelli, B.; van Hees, R.P.J.; Huinik, H.P.; Groot, C.J.W.P. (2006): Irreversible dilation of NaCl contaminated lime -cement mortar due to crystallization cycles. In: Cement and Concrete Research, 36 (4), 678-687, https://doi.org/10.1016/j.cemconres.2005.10.008 |  |
| [Lubelli.etal:2006a] | Lubelli, B.; van Hees, R.P.J.; Huinink, H.P. (2006): Effect of NaCl on the hydric and hygric dilation behaviour of lime-cement mortar. In: HERON, 51 (1), 33-48 |   |
| [Lubelli.etal:2010a] | Lubelli, B.; nijland, T.G.; Van Hees, R.P.J.; Hacquebord, A. (2010): “Effect of mixed in crystallization inhibitor on resistance of lime-cement mortar against NaCl crystallization. In: Construction and Building Materials, 24 (12), 2466-2472, Webadresse, https://doi.org/10.1016/j.conbuildmat.2010.06.010 |  |
| [Marliacy.etal:2000] | Marliacy, P.; Solimando, R.; Bouroukba, M.; Schuffenecker, L. (2000): Thermodynamics of crystallization of sodium sulfate decahydrate in H2O-NaCl-Na2SO4: application to Na2SO4.cntdot.10H2O-based latent heat storage materials. In: Thermochim. Acta, 344 (1), 85-94 |  |
| [Monnin:1990] | Monnin, C. (1990): The influence of pressure on the activity coefficients of the solutes and on the solubility of minerals in the system Na-Ca-Cl-SO4-H2O to 200°C and 1 kbar, and to high NaCl concentration. In: Geochimica et Cosmochimica Acta, 54 (12), 3265-3282, 10.1016/0016-7037(90)90284-R |  |
| [Moropoulou.etal:1992] | Moropoulou, Antonia; Theoulakis, Panagiotis (1992): Conditions causing destructive NaCl crystallization into the porous sandstone, building material of the medieval city of Rhodes. In: Decrouez, Danielle; Chamay, Jacques; Zezza, Fulvio (Hrsg.): The conservation of monuments in the Mediterranean Basin: proceedings of the 2nd international symposium, Musee d'Art et d'Histoire-Geneve; Museum d'Histoire Naturelle, 493-499. |  |
| [Ottosen.etal:2017] | Ottosen, Lisbeth M.; Andersson, Lovisa C. H. (2017): Electrode placement during electro-desalination of NaCl contaminated sandstone – simulating treatment of carved stones. In: Laue, Steffen (Hrsg.): Proceedings of SWBSS 2017. Fourth International Conference on Salt Weathering of Buildings and Stone Sculptures, University of Applied Sciences Potsdam, Germany, 20-22 September 2017,Verlag der Fachhochschule Potsdam 150-157, 10.5165/hawk-hhg/332. |   |
| [Pitzer:1986] | Pitzer, K. S. (1986): Thermodynamics of NaCl in steam. In: Geochemica et Cosmochimica Acta, 50 (7), 1445-1454 |  |
| [Platford:1975] | Platford, R. F. (1975): Thermodynamics of the system H2O-NaCl-MgCl2-Na2SO4-MgSO4 at 25 degrees C. In: Mar. Chem., 3 (4), 261-270 |  |
| [Potter.etal:1978] | Potter, R. W. I.; Clynne, M. A. (1978): Solubility of high soluble salts in aqueous media; Part 1, NaCl, KCl, CaCl2, Na2SO4, and K2SO4 solubilities to 100 degrees C. In: Journal of Research of the U. S. Geological Survey, 6 (6), 701-705 |  |
| [Ptacek.etal:1992] | Ptacek, C. J.; Reardon, E. J. (1992): Solubility of siderite (FeCO3) in concentrated NaCl and Na2SO4 solutions at 25 degrees C. In: Kharaka, Yousif K.; Maest, Ann S. (Hrsg.): Proceedings of the 7th international symposium on water-rock interaction, 181-184. |  |
| [Rodriguez-Navarro.etal:2002] | Rodriguez-Navarro, Carlos; Linares-Fernandez, Lucia; Doehne, Eric; Sebastian, Eduardo (2002): Effects of ferrocyanide ions on NaCl crystallization in porous stone. In: Journal of Crystal Growth, 243 (3), 503-516, Webadresse |  |
| [Sarada.etal:1990] | Sarada, S.; Ananthaswamy, J. (1990): Thermodynamic Properties of Electrolyte Solutions: Emf Study of the System NaCl-Na2SO4-H20 at 25, 35 and 45 ÄC. In: Journal Chem. Soc. Faraday Trans., 86 (1), 81-84 |  |
| [Shen.etal:2020] | Shen, Y.; Linnow, K.; Steiger, M. (2020): Crystallization Behavior and Damage Potential of Na2SO4-NaCl Mixtures in Porous Building Materials. In: Crystal Growth & Design, 20 (9), 5974-5985, https://doi.org/10.1021/acs.cgd.0c00671 |  |
| [Shichiri.etal:1965] | Shichiri, T.; Kato, N. (1965): The growth and dissolution of NaCl whiskers in aqueous solution. In: Acta Metallurg., 13 (), 785-795 |  |
| [Shichiri.etal:1967] | Shichiri, T.; Kinoshita, H.; Kato, N. (1967): Regrowth of NaCl and KCl whiskers in aqueous solution. In: Peiser, H.S. (Hrsg.): Crystal Growth, , 385-388. |  |
| [Shichiri.etal:1968] | Shichiri, T.; Kato, N. (1968): Regrowth of NaCl whiskers from pure and poisoned solutions. In: Journal of Crystal Growth, 3/4 (), 384-390, Webadresse |  |
| [Simon:1981] | Simon, B. (1981): Dissolution rates of NaCl and KCl in auqeous solution. In: Journal of Crystal Growth, 52 (2), 789-794, Webadresse |  |
| [Simon:1983] | (1983): Influence of the direction of the solution flow on the morphology of NaClO3 crystals. In: Journal of Crystal Growth, 61 (1), 167-169, Webadresse |  |
| [Sonnleitner:2011] | Sonnleitner,Tobias (2011): Symmetrien und Manipulation des Ladungszustands von Molekülen auf NaCl-Filmen, Webadresse. |  |
| [Talreja-Muthreja.etal:2022] | Talreja-Muthreja, T.; Linnow, K.; Enke, D.; Steiger, M. (2022): Deliquescence of NaCl Confined in Nanoporous Silica. In: Langmuir, 38 (36), 10963-10974, https://doi.org/10.1021/acs.langmuir.2c01309 |  |
| [Taye.etal:2022] | Taye, B.; Viles, H.; Zhang, H. (2022): Influence of salt (NaCl) on hydric and hygric dilatation of clay-rich rocks. In: Journal of Cultural Heritage, 58 (), 137-145, Webadresse |  |
| [Tishchenko.etal:1992] | Tishchenko, Pavel Ya.; Bychkov, Alexander S.; Hravéczy-Páll, Andrea; Tóth, Klára; Pungor, Ernoe (1992): Activity Coefficients for the System NaCl + Na2SO4 + H2O at Various Temperatures. Application of Pitzer's Equations. In: Journal of Solution Chemistry, 21 (3), 261-274 |  |
| [Vazquez.etal:2014] | Vázquez, P.; Thomachot-Schneider, C.; Mouhoubi, K.; Gommeaux, M.; Fronteau, G.; Barbin, V.; Bodnar, J.L. (2014): Study of NaCl crystallization using Infrared Thermography. In: Hilde De Clercq (Hrsg.): Proceedings of SWBSS 2014 3rd International Conference on Salt Weathering of Buildings and Stone Sculptures,KIK-IRPA, Royal Institute for Cultural Heritage Brussels 289-303, 10.5165/hawk-hhg/274. |   |
| [Wolf.etal:1992] | Wolf, Manfred; Rohde, Harald (1992): Solubility of calcite in mixed aqueous solutions of NaCl and KCl at 25 degrees C and CO2 partial pressures of about 1 kPa. In: Proceedings of the 7th international symposium on water rock interaction, 7 (), 195 |  |
| [Yellin.etal:1985] | Yellin, N.; Zelingher, N.; Ben-Dor, L. (1985): Whiskers growth by means of cellulose acetate membranes: NaCl and KCl. In: Journal of Crystal Growth, 71 (2), 427-432, Webadresse |  |
| [Zdanovskii.etal:1991] | Zdanovskii, A. B.; Frolovskii, E. E. (1991): Equations for calculating the solubility of mirabilite in the aqueoussodium chloride-magnesium sulfate (2NaCl + MgSO4 = Na2SO4 + MgCl2) system at 0-25.degree. In: Zh. Prikl. Khim. (Leningrad), 64 (6), 1153-7 |  |
| [Zelingher:1975] | Zelingher, N. (1975): A new method of growing NaCl and KCl whiskers. In: Acta Crystallogr., A 31 Suppl., (), 211 |  |