Kieserit
<bibimport/>
| Kieserit{{{Footnote}}} | |
| HJS MgSO4 092503-3.jpg | |
| Mineralogische Salzbezeichnung | Kieserit |
| Chemische Bezeichnung | Magnesiumsulfathydrat |
| Trivialname | Bittersalz |
| Chemische Formel | Mg[SO4] • H2O |
| Hydratformen | Sanderit (MgSO4•2H2O) Starkeyit (MgSO4•4H2O) Pentahydrit (MgSO4•5H2O) Hexahydrit (MgSO4•6H2O) Epsomit (MgSO4•7H2O) Meridianiit (MgSO4•11 H2O) Magnesium 12-Hydrat |
| Kristallsystem | {{{Kristallsystem}}} |
| Deliqueszenzfeuchte 20°C | |
| Löslichkeit(g/l) bei 20°C | {{{Löslichkeit}}} |
| Dichte (g/cm³) | 2,57 g/cm3 |
| Molares Volumen | 53,85 cm3/mol |
| Molare Masse | 138,9 g/mol |
| Transparenz | durchsichtig bis durchscheinend |
| Spaltbarkeit | vollkommen |
| Kristallhabitus | bipyramidale Kristalle, oft stark deformiert, körnige, massige Aggregate |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | |
| Kristalloptik | |
| Brechungsindices | nx = 1,523-1,520 ny = 1,535-1,533 nz = 1,586-1,584 |
| Doppelbrechung | Δ = 0,063-0,064 |
| Optische Orientierung | zweiachsig positiv |
| Pleochroismus | farblos |
| Dispersion | 55° |
| Verwendete Literatur | |
| {{{Literatur}}} | |
Autoren: Hans-Jürgen Schwarz, NN....
Abstract[Bearbeiten]
Einleitung[Bearbeiten]
Allgemeines[Bearbeiten]
Vorkommen von Kieserit
[Bearbeiten]
Kieserit bildet in der Natur selten Einzelkristalle aus. Das Magnesiumsulfathydrat kommt in Lagerstätten zusammen mit Sylvin und Steinsalz vor, diese finden sich in den Allpen und in Norddeutschland, Italien (Vesuv), Arizona (Bisbee), Nevada, Whashington (Mt. Kruger). Häufiger kommt Epsomit als Ausblühung an Gesteinswänden magnesiumhaltiger Gesteine vor, dabei handelt es sich meist auch um Gesteine mit hohem Karbonatanteil (Kalzit oder Dolomit). Außerdem bildet es sich bei dem Eindampfen von Gewässern oder als Sekundärmineral bei der Oxidation von Eisensulfiden. An Oberflächen von Bauwerken kommt es ebenfalls vor, wo es zu gravierenden Schäden führen kann.
Angaben zu Herkunft und Bildung von Kieserit an Baudenkmalen
[Bearbeiten]
Magnesiumsulfate bilden sich an Baustoffen, sofern diese eine Quelle für Magnesiumionen darstellen. Diese können verschiedene Baustoffe bilden.
- Kalk mit dolomitischem Anteil:
Dolomit ist ein Doppelsalz, das sowohl Kalzium als auch Magnesium beinhaltet. Der negative Ladungsträger wird durch das Karbonation gebildet. Für die Mörtelherstellung wird Kalk verwendet, der Dolomit enthalten kann. Durch das Brennen und Löschen entstehen reine Salze (CaCO3 und MgCO3). Die Löslichkeit des Magnestis (1,76 g/l) ist deutlich höher als die des reinen Kalzits (0,014 g/l) oder des Dolomits (0,078 g/l). Tritt in dem Baustoff Feuchte auf, können die Magnesiumverbindungen gelöst werden und bei dem Entzug der Feuchtigkeit wieder als Salze ausfallen. Hierbei können die Sulfate gebildet werden, insbesonder wenn durch die Verwendung von Gipshaltiger Produkte am selben Objekt die Sulfationen zur Verfügung gestellt werden.
CaMg[CO3]2 -> CaCO3 + MgCO3
MgCO3 + n H2O -> Mg2+ aq + CO32- aq
Mg2+ + SO42- -> MgSO4
- Magnesiabinder:
Magnesiabinder beinhaltet ebenfalls Magnesiumverbindungen, die hygroskopische Salze bilden können. Diese stellen eine Magnesiumquelle dar, und können in Verbindung mit Sulfationen zu Magnesiumsulfaten umgebildet werden.
- Zement:
Auch in Zement ist Magnesium enthalten. Um Schäden vorzubeugen ist in Zement laut DIN 1164 nu ein Höchstgehalt von 5M% zugelassen, weil das Magnesium auch aus dem Zement herausgelöst werden und Sulfate bilden kann. Eine weitere Quelle für Magnesiumionen in einer Lösung kann Streusalz bilden, weil dieses oft geringe Mengen von MgCl2 enthält. Des weiteren können auch Ionen aus der Bodenlösung ein Problem darstellen, sofern diese durch kapillaren Aufstieg an die Oberfläche transortiert werden.
Angaben zum Schadenspotential und zur Verwitterungsaktivität von Kieserit[Bearbeiten]
Lösungsverhalten
[Bearbeiten]
(vgl.Tabelle Hygroskopizität der Salze und Gleichgewichtsfeuchte)
Hygroskopizität[Bearbeiten]
Die geringe Hygroskopizität des Reinsalzes Kieserit, die in dem hohen Wert der Gleichgewichtsfeuchte im Bereich % r.F. deutlich wird, kann nicht isoliert betrachtet werden. In Mischsystemen, d.h. unter dem Einfluss von Fremdionen, liegt der Sorptionspunnkt tiefer. Die Möglichkeit der hygroskopischen Feuchteaufnahme mit den damit verbundenen Problematiken ist trotz des hohen Deliqueszenzpunktes durchaus gegeben. [Mainusch:2001]Titel: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Autor / Verfasser: Mainusch, Nils
Feuchtesorption:
Kristallisationsdruck
[Bearbeiten]
Hydratationsverhalten[Bearbeiten]
Hydratationsdruck
[Bearbeiten]
Umwandlungsreaktionen
[Bearbeiten]
Analytischer Nachweis[Bearbeiten]
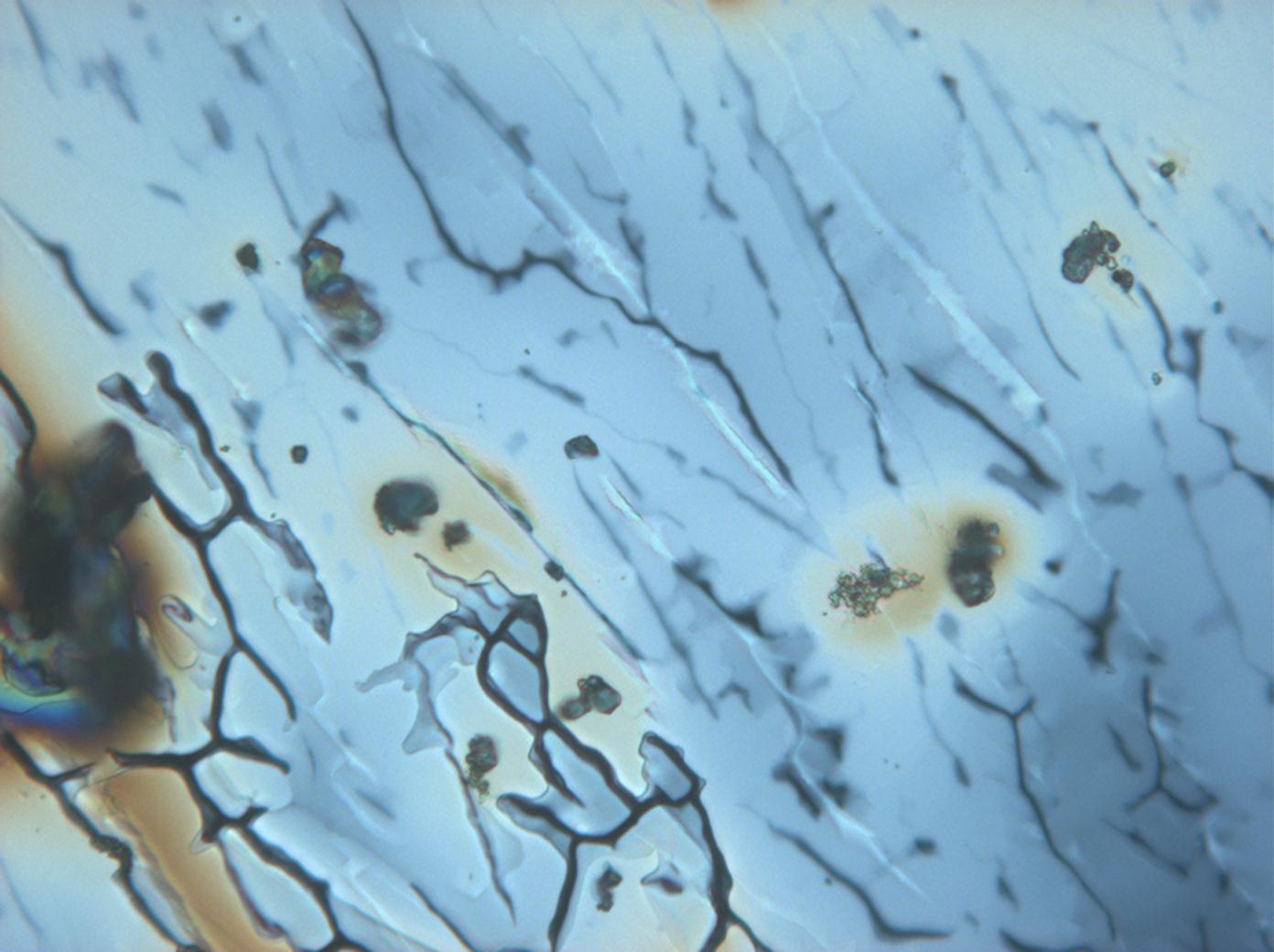
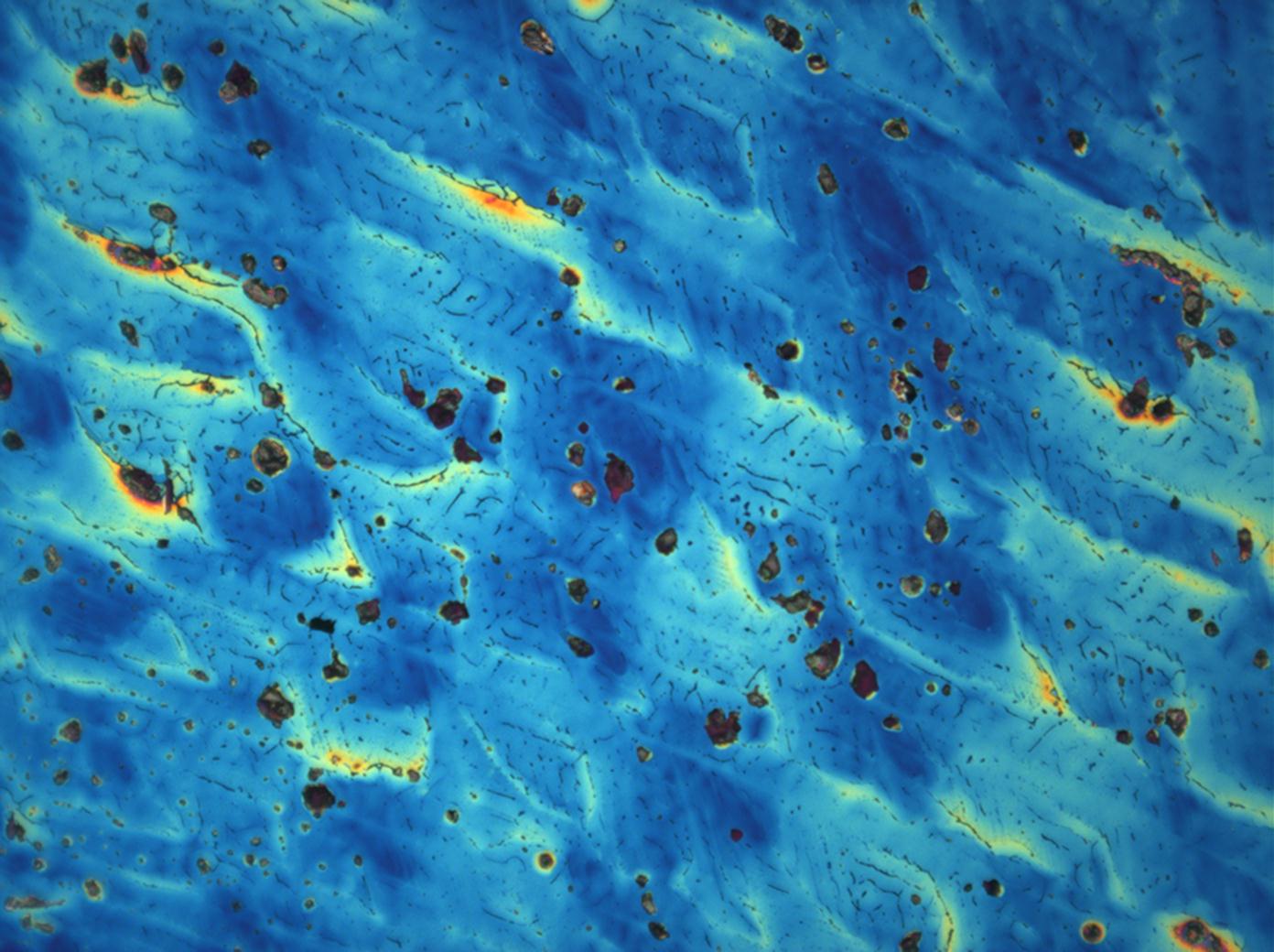
Mikroskopie
[Bearbeiten]
Laboruntersuchung:
Brechungsindizes: nx = ; ny =; nz =
Doppelbrechung: Δ =
Kristallklasse:
Polarisationsmikroskopische Untersuchung:
Verwechslungsmöglichkeiten:
| Salzphase | Unterscheidungsmerkmale zu |
Betrachtung von Mischsystemen:
Röntgendiffraktometrie[Bearbeiten]
Raman-Stektroskopie[Bearbeiten]
DTA / TG[Bearbeiten]
IR-Spektroskopie[Bearbeiten]
Umgang mit Kieseritschäden[Bearbeiten]
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
Unter dem Rasterelektronenmikroskop[Bearbeiten]
Weblinks
[Bearbeiten]
http://webmineral.com/data/Kieserite.shtml
http://www.mindat.org/min-2204.html
http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Kieserit
Literatur[Bearbeiten]
[Filter fehlt]