Mikrochemischer Nachweis Magnesium: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
|||
| (5 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autor: [[Benutzer:CBlaeuer|Christine Bläuer]] | Autor: [[Benutzer:CBlaeuer|Christine Bläuer]] | ||
| Zeile 23: | Zeile 21: | ||
Der Probetropfen wird mit sehr wenig 2M Salzsäure angesäuert, mit Natriumhydrogenphosphat-Lösung versetzt und ein Körnchen Cäsiumchlorid dazugegeben. | Der Probetropfen wird mit sehr wenig 2M Salzsäure angesäuert, mit Natriumhydrogenphosphat-Lösung versetzt und ein Körnchen Cäsiumchlorid dazugegeben. | ||
Falls Mg<sup>2+</sup> vorhanden ist, bilden sich rasch sehr kleine, oktaedrische Caesiummagnesiumphosphat-Kristalle (CsMgPO<sub>4</sub>.6H<sub>2</sub>O) nahe des sich | Falls Mg<sup>2+</sup> vorhanden ist, bilden sich rasch sehr kleine, oktaedrische Caesiummagnesiumphosphat-Kristalle (CsMgPO<sub>4</sub>.6H<sub>2</sub>O) nahe des sich lösenden CsCl-Körnchens. (Erfassungsgrenze für Mg<sup>2+</sup> = 1 µg) | ||
'''''Störungen:''''' | '''''Störungen:''''' | ||
| Zeile 30: | Zeile 28: | ||
Ca-Ionen können zu weißen, schleierähnlichen Ausfällungen von Calcium-Phosphat führen und die Beobachtung be- oder verhindern. | Ca-Ionen können zu weißen, schleierähnlichen Ausfällungen von Calcium-Phosphat führen und die Beobachtung be- oder verhindern. | ||
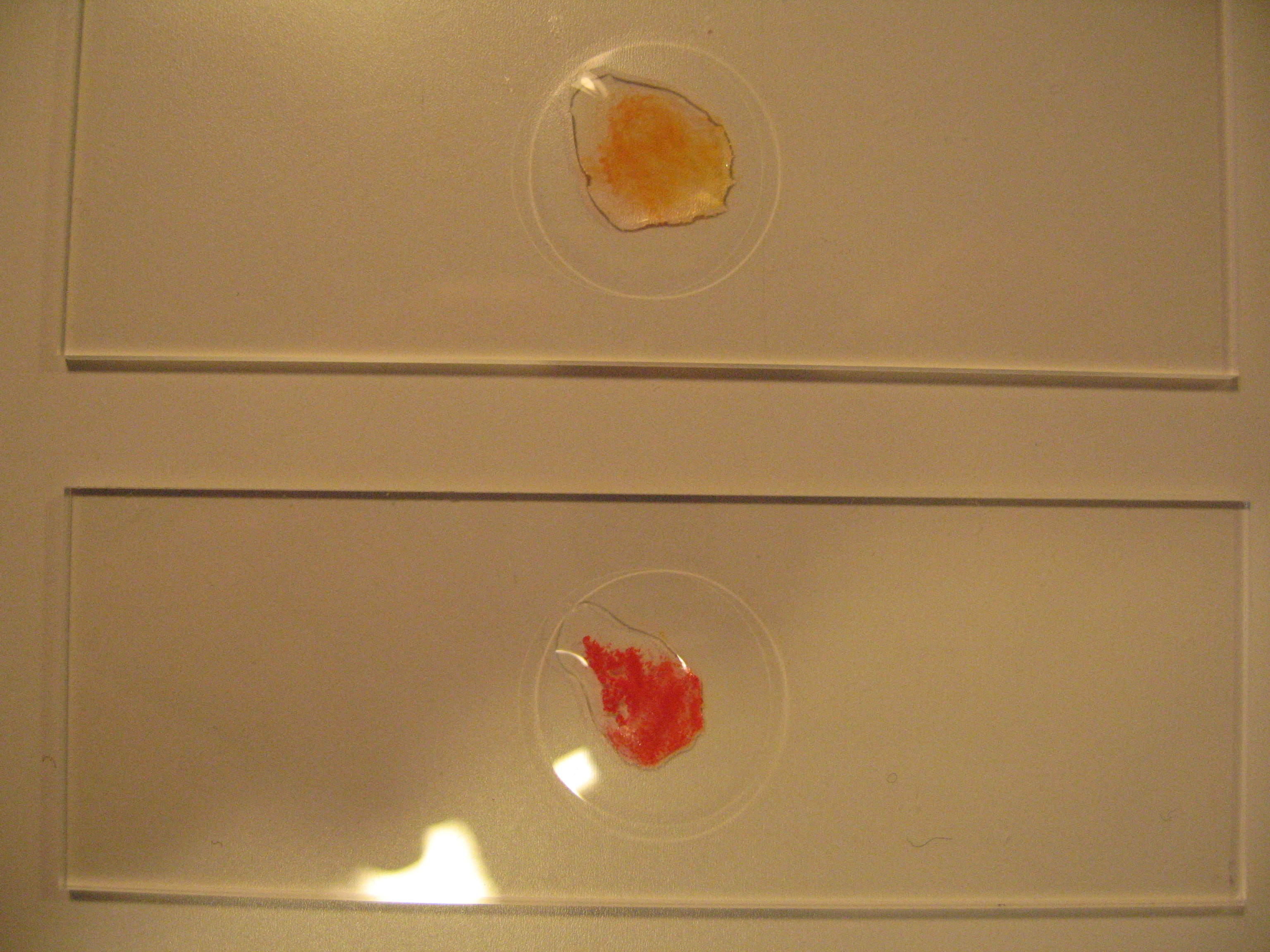
[[Image:TestForMg Titanyellow 6622.JPG |thumb|right|300px|Abbildung 1: Mikroschemischer Nachweis von Mg<sup>2+</sup> mit Titangelb-Lösung. Oben negatives Ergebnis bei Ca<sup>2+</sup>-haltiger Probe; unten positives Ergebnis für Mg<sup>2+</sup>]] | |||
<br> '''Mg-Test mit Titangelb''' nach <ref>https://www.uni-rostock.de/fakult/medfak/biochem/materialien/praktikum/med/zahnhartgewebe_speichel.pdf</ref> | <br> '''Mg-Test mit Titangelb''' nach <ref>https://www.uni-rostock.de/fakult/medfak/biochem/materialien/praktikum/med/zahnhartgewebe_speichel.pdf</ref> | ||
| Zeile 42: | Zeile 42: | ||
Nickel-, Zink-, Mangan- und Cobalt-Ionen stören diesen Nachweis <ref>http://de.wikipedia.org/wiki/Magnesium#Nachweis</ref> | Nickel-, Zink-, Mangan- und Cobalt-Ionen stören diesen Nachweis <ref>http://de.wikipedia.org/wiki/Magnesium#Nachweis</ref> | ||
<!-- | |||
== Weblinks == | == Weblinks == | ||
<references /> | <references /> | ||
== Literatur == | == Literatur == | ||
< | <biblist/> | ||
--> | --> | ||
[[Category:Mikrochemie]] [[Category: | [[Category:Mikrochemie]] [[Category:Bläuer,Christine]] [[Category:R-MSteiger]] [[Category:R-CBlaeuer]] [[Category:Review]] | ||
Aktuelle Version vom 11. Juni 2012, 14:07 Uhr
Autor: Christine Bläuer
Nachweis von Magnesium (Mg2+)
Nähere Informationen zu den benötigten Materialien finden Sie im Artikel Mikrochemie.
Vorgehen
Mg-Test mit Ammoniumhydrogenphosphat und Ammoniak
Der Probetropfen wird mit sehr wenig 2M Salzsäure angesäuert und mit Ammoniumhydrogenphosphat-Lösung versetzt. Der so vorbereitete Tropfen wird entweder mit 2M Ammoniaklösung versetzt, oder er wird über die Dämpfe von konz. Ammoniak gehalten (Objektträger schnell umdrehen!).
Wenn Mg-Ionen in der Lösung vorhanden sind, bilden sich in der Tropfenmitte typische Magnesiumammoniumphosphat-Kristalle (MgNH4PO4.6H2O). (Erfassungsgrenze für Mg2+ = 0.05 µg)
Störungen:
Wenn Ca-Ionen in der Lösung sind, bilden diese eine weiße, schleierähnliche Ausfällung von Calcium-Phosphat, die das Beobachten des Magnesiumammoniumphosphats be- oder gar verhindern kann.
Mg-Test mit Cäsiumchlorid und Natriumhydrogenphosphat
Der Probetropfen wird mit sehr wenig 2M Salzsäure angesäuert, mit Natriumhydrogenphosphat-Lösung versetzt und ein Körnchen Cäsiumchlorid dazugegeben.
Falls Mg2+ vorhanden ist, bilden sich rasch sehr kleine, oktaedrische Caesiummagnesiumphosphat-Kristalle (CsMgPO4.6H2O) nahe des sich lösenden CsCl-Körnchens. (Erfassungsgrenze für Mg2+ = 1 µg)
Störungen:
Ionen der Elemente Sr, Ba, Zn, Cd, Sn, Pb, Ag und Cu stören oder maskieren die Reaktion.
Ca-Ionen können zu weißen, schleierähnlichen Ausfällungen von Calcium-Phosphat führen und die Beobachtung be- oder verhindern.
Mg-Test mit Titangelb nach [1]
Auf der Tüpfelplatte wird 1 Tropfen der, mit verdünnter Salzsäure angesäuerten, Probenlösung mit einem Tropfen Titangelb-Lösung versetzt. Nach Zugabe von 1-2 Tropfen Natronlauge wird das Ganze mit einem Glasstab verrührt.
Bei Anwesenheit von Mg2+ bildet sich ein roter, flockiger Niederschlag. (Erfassungsgrenze Mg2+ ca. 1,5 μg).
Störungen:
Calcium gibt nur eine leicht orangerote Färbung der Lösung, die kaum mit dem roten flockigen Niederschlag verwechselt werden kann (Kontrolle mithilfe bekannter Substanzen machen).
Nickel-, Zink-, Mangan- und Cobalt-Ionen stören diesen Nachweis [2]