Bischofit
Zur Navigation springen
Zur Suche springen
Autoren: Hans-Jürgen Schwarz
zurück zu Chloride
| Bischofit[1][2][3] | |
| Mineralogische Salzbezeichnung | Bischofit |
| Chemische Bezeichnung | Magnesiumchlorid Hexahydrat |
| Trivialname | |
| Chemische Formel | MgCl2•6H2O |
| Hydratformen | |
| Kristallsystem | monoklin |
| Deliqueszenzfeuchte 20°C | 33,1% |
| Löslichkeit(g/l) bei 20°C | 5,75 mol/kg |
| Dichte (g/cm³) | 1,57 g/cm3 |
| Molares Volumen | 129,6 cm3/mol |
| Molare Masse | 203,30 g/mol |
| Transparenz | |
| Spaltbarkeit | keine |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | zersetzt sich bei 116-118°C hygroskopisch bis zerfließend |
| Kristalloptik | |
| Brechungsindices | nx =1,495 ny = 1,509 nz = 1,528 |
| Doppelbrechung | Δ = 0,003 |
| Optische Orientierung | positiv |
| Pleochroismus | |
| Dispersion | 79° |
| Verwendete Literatur | |
| [Steiger.etal:2014]Titel: Weathering and Deterioration Autor / Verfasser: Steiger, Michael; Charola A. Elena; Sterflinger, Katja  [Broul.etal:1981]Titel: Solubility in organic two component systems [Broul.etal:1981]Titel: Solubility in organic two component systemsAutor / Verfasser: Broul M., Nyvlt J.; Soehnel O.  [Dana:1951]Titel: Dana's System of Mineralogy [Dana:1951]Titel: Dana's System of MineralogyAutor / Verfasser: Dana J.D.  [Steiger.etal:2011a]Titel: Decomposition reactions of magnesium sulfate hydrates and phase equilibria in the MgSO4-H2O and Na+-Mg2+-Cl--SO42--H2O systems with implications for Mars [Steiger.etal:2011a]Titel: Decomposition reactions of magnesium sulfate hydrates and phase equilibria in the MgSO4-H2O and Na+-Mg2+-Cl--SO42--H2O systems with implications for MarsAutor / Verfasser: Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M. 
| |
Lösungsverhalten[Bearbeiten]
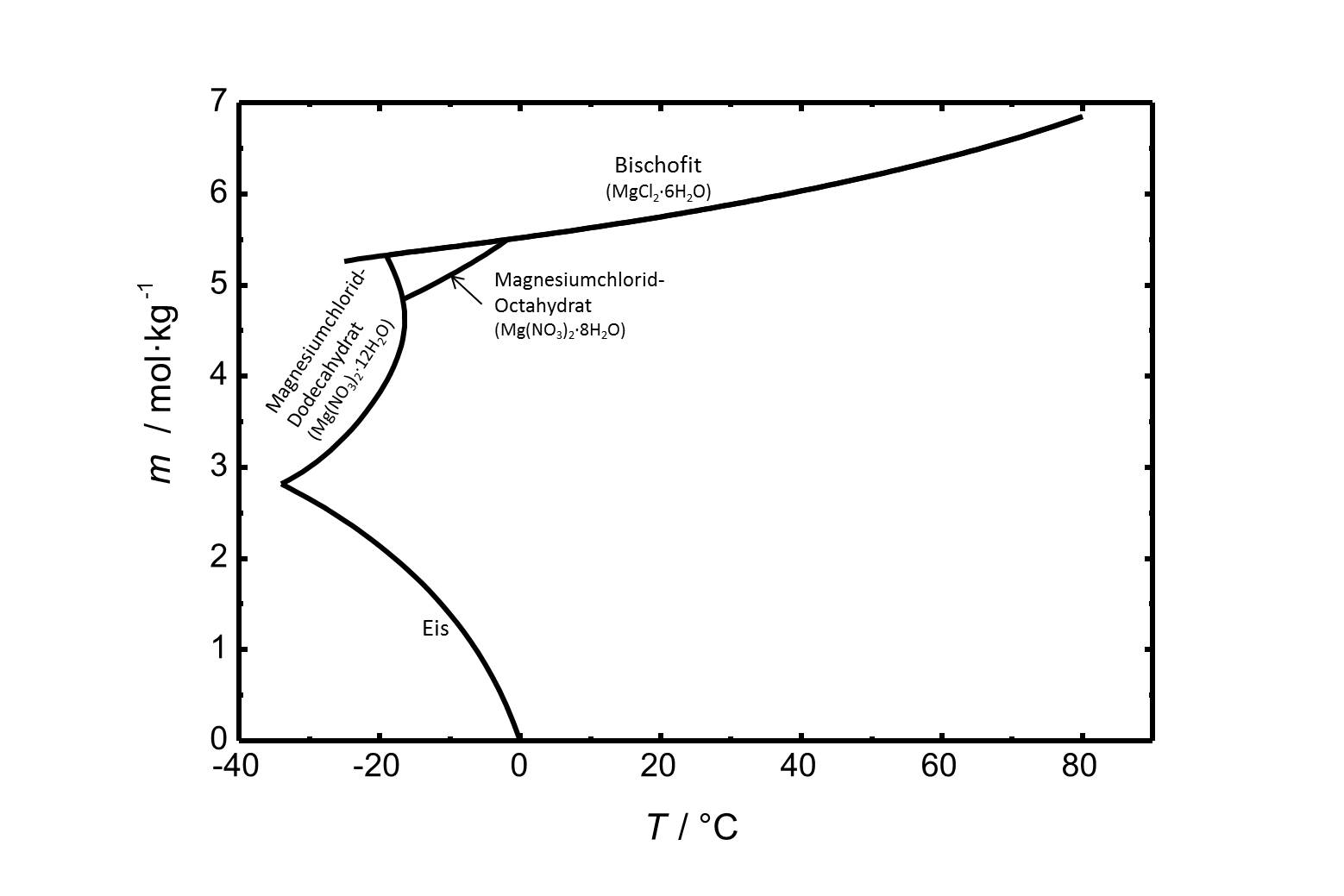
Die Löslichkeit von Magnesiumchlorid in Wasser im Temperaturbereich von -40 bis 80 °C ist in Abbildung 1 gezeigt. Die Löslichkeit von Bischofit bei 20 °C beträgt 5,75 mol/kg.
Hygroskopizität[Bearbeiten]
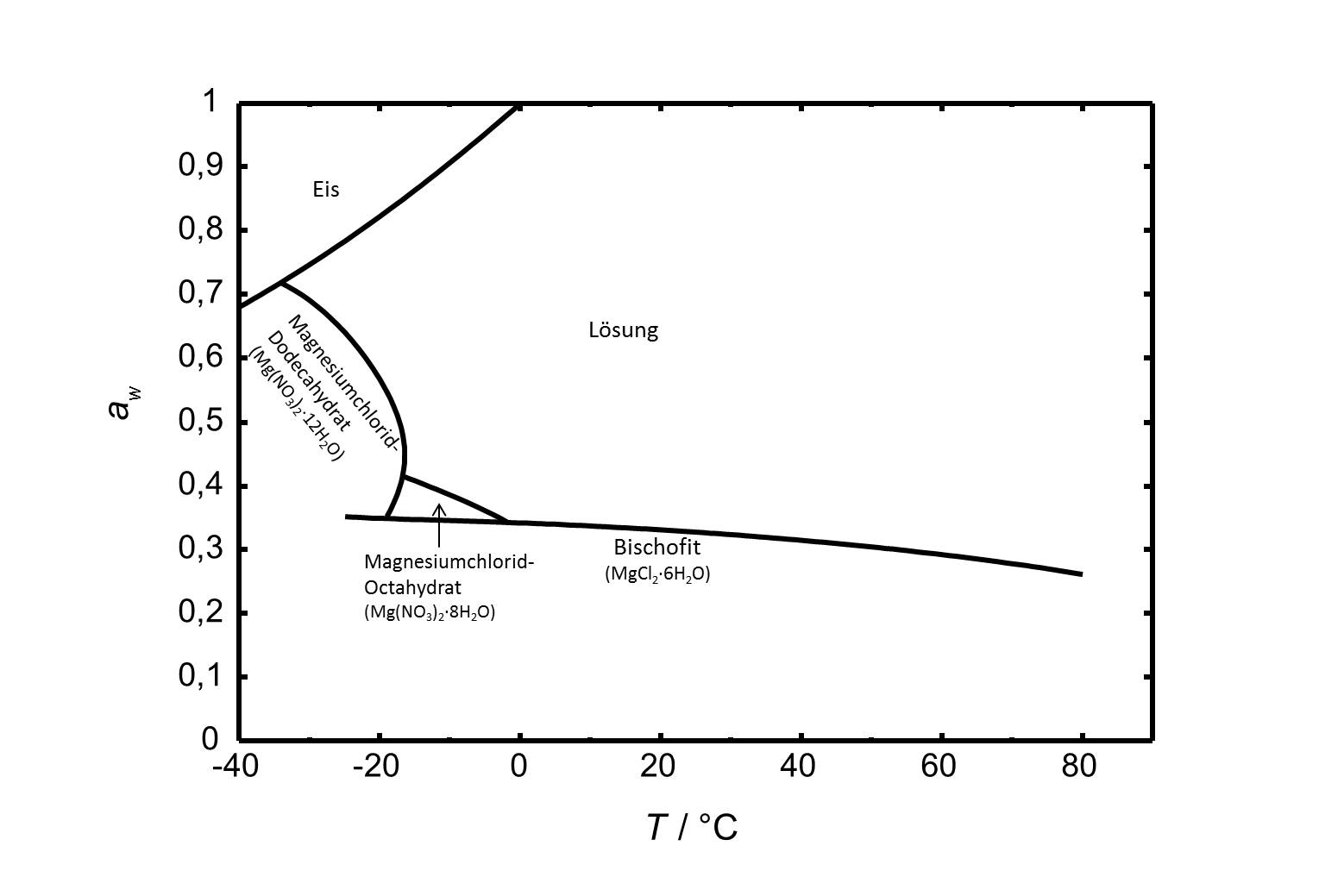
Das Phasendiagramm des Systems MgCl2-H2O ist in Abbildung 2 gezeigt. Neben Bischofit gibt es in dem betrachteten Temperaturbereich von -40 bis 80 °C noch zwei weitere stabile Hydratstufen. Das Octa- und das Dodecahydrat sind bei niedrigen Temperaturen relevant.
| 0°C | 10°C | 20°C | 30°C | 40°C | 50°C |
| 34,1%r.F. | 33,7%r.F. | 33,1%r.F. | 32,4%r.F. | 31,5%r.F. | 30,5%r.F. |
Weblinks[Bearbeiten]
- ↑ http://webmineral.com/data/Bischofite.shtml gesehen 29.07.2010
- ↑ http://www.mindat.org/min-681.html gesehen 29.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Bischofit gesehen 29.07.2010
Literatur[Bearbeiten]
| [Broul.etal:1981] | Elsevier (Hrsg.) Broul M., Nyvlt J.; Soehnel O. (1981): Solubility in organic two component systems, Elsevier |  |
| [Dana:1951] | Dana E.S. (Hrsg.) Dana J.D. (1951): Dana's System of Mineralogy, 7, Wiley & Sons |  |
| [Steiger.etal:2011a] | Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M. (2011): Decomposition reactions of magnesium sulfate hydrates and phase equilibria in the MgSO4-H2O and Na+-Mg2+-Cl--SO42--H2O systems with implications for Mars. In: Geochimica et Cosmochimica Act, 75 (12), 3600-3626, https://doi.org/10.1016/j.gca.2011.03.038 |  |
| [Steiger.etal:2014] | Steiger, Michael; Charola A. Elena; Sterflinger, Katja (2014): Weathering and Deterioration. In: Siegesmund S.; Snethlage R. (Hrsg.): Stone in Architecture, Springer Verlag Berlin Heidelberg, 223-316, Webadresse, https://doi.org/10.1007/978-3-642-45155-3_4. |  |