Mirabilit
Autoren: Hans-Jürgen Schwarz , Nils Mainusch
zurück zu Sulfate
| Mirabilit[1][2][3] | |

| |
| Mineralogische Salzbezeichnung | Mirabilit |
| Chemische Bezeichnung | Natriumsulfat-Decahydrat |
| Trivialname | Glaubersalz, Reussin, Wundersalz |
| Chemische Formel | Na2SO4•10H2O |
| Hydratformen | Na2SO4•7H2O (Natriumsulfat-Heptahydrat) |
| Kristallsystem | monoklin |
| Deliqueszenzfeuchte 20°C | 95,6 % |
| Löslichkeit(g/l) bei 20°C | 900 g/l |
| Dichte (g/cm³) | 1,466 g/cm³ |
| Molares Volumen | 219,8 cm3/mol |
| Molare Masse | 322,19 g/mol |
| Transparenz | durchsichtig bis undurchsichtig |
| Spaltbarkeit | vollkommen bis schlecht |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | löslich in Wasser und Glycerin, in wasserfreiem Ethanol unlöslich verliert leicht etwas Wasser, geht bei 32°C in Thenardit über; anomale blaue oder braune Interferenzfarben |
| Kristalloptik | |
| Brechungsindices | nx = 1,394 ny = 1,396 nz = 1,398 |
| Doppelbrechung | Δ = 0,004 |
| Optische Orientierung | negativ |
| Pleochroismus | |
| Dispersion | 76° |
| Verwendete Literatur | |
| [Robie.etal:1978]Titel: Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures Autor / Verfasser: Robie R.A., Hemingway B.S.; Fisher J.A.  [Dana:1951]Titel: Dana's System of Mineralogy [Dana:1951]Titel: Dana's System of MineralogyAutor / Verfasser: Dana J.D. 
| |
Abstract[Bearbeiten]
Vorkommen von Mirabilit[Bearbeiten]
siehe Natriumsulfat
Angaben zu Herkunft und Bildung von Mirabilit an Baudenkmalen[Bearbeiten]
siehe Natriumsulfat
Lösungsverhalten[Bearbeiten]
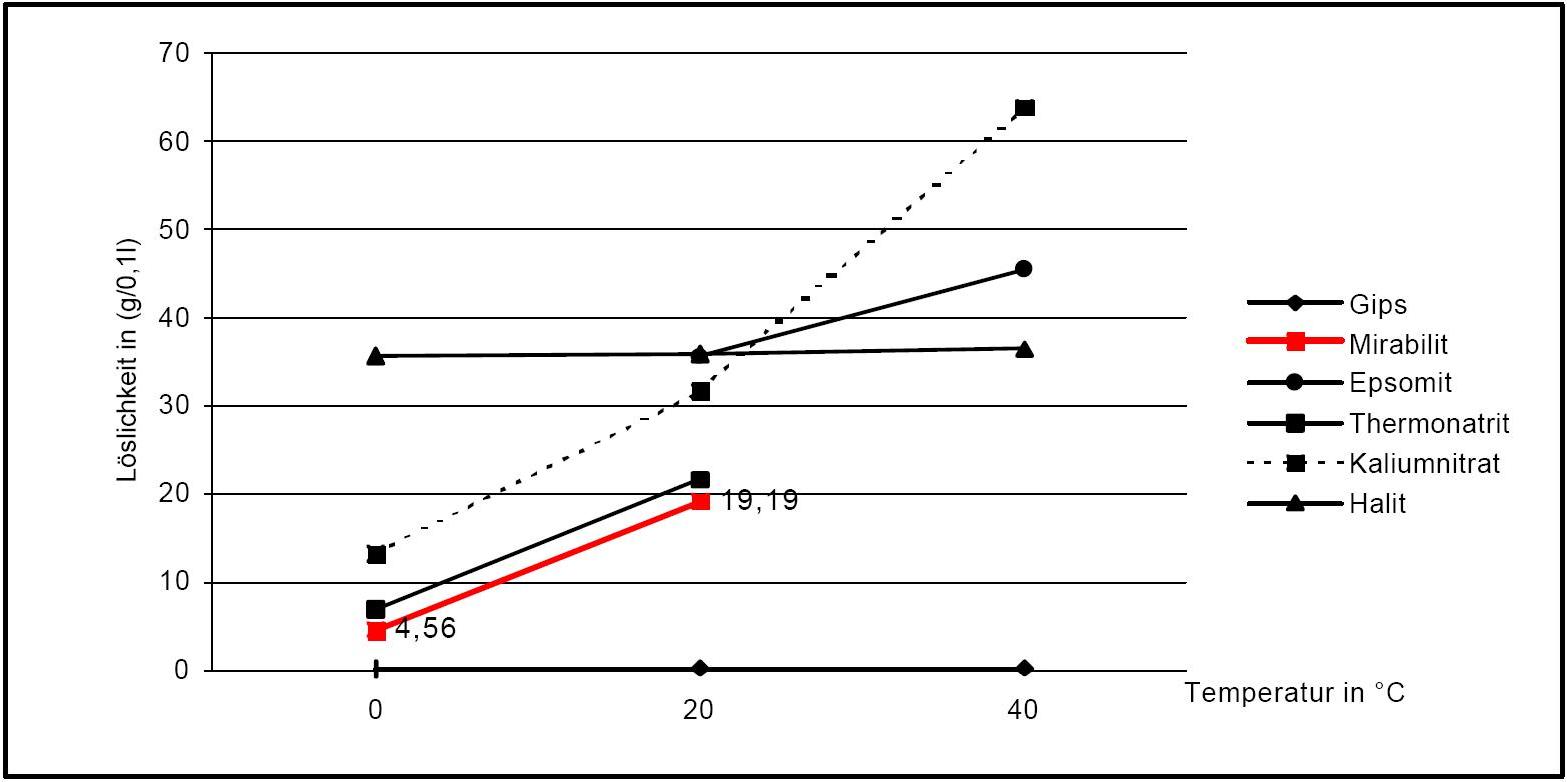
Vergleich mit anderen Salzphasen [Angaben nach [Stark.etal:1996]Titel: Bauschädliche Salze
Autor / Verfasser: Stark, Jochen; Stürmer, Sylvia
 ].
].siehe Natriumsulfat
Hygroskopizität[Bearbeiten]
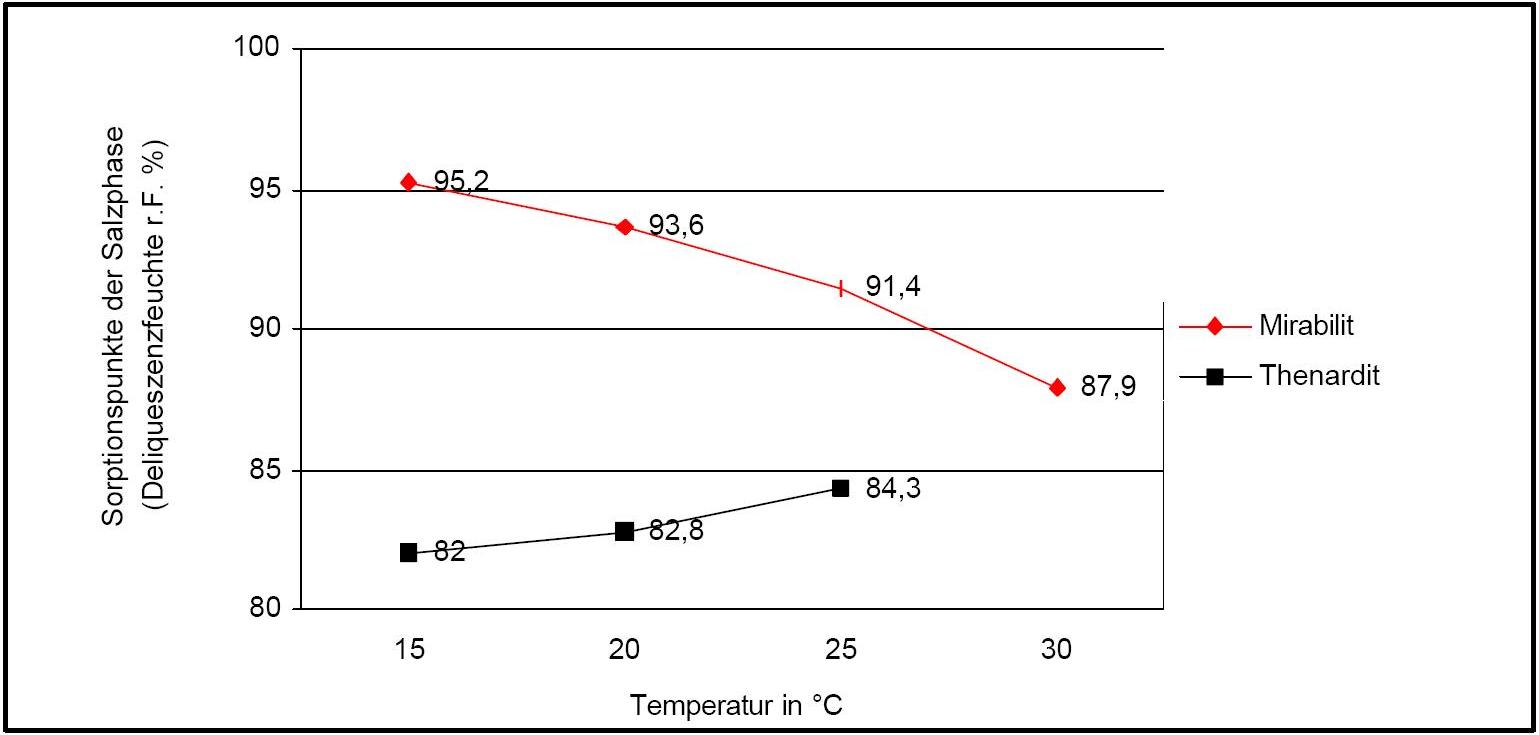
Autor / Verfasser: Arnold, Andreas; Zehnder, Konrad

In Abbildung 2 ist der Temperatureinfluss auf die Deliqueszenzpunkte von Thenardit und Mirabilit verdeutlicht. Auffällig sind hierbei die gegenläufigen Kurvengänge.
In Anwesenheit von Fremdionen (bei Salzgemischen) verändern sich die Parameter der Deliqueszenzfeuchte und der notwendigen Temperatur- und Feuchtebedingungen für Umkristallisationen zudem deutlich. Als orientierende Daten sind in Tabelle 1 experimentell erfasste Werte der Deliqueszenzfeuchte in unterschiedlichen Salzgemischen wiedergegeben. Es zeigt sich, dass alle Werte der Deliqueszenzfeuchte unter denen des Reinsalzes Mirabilit liegen.
| MgSO4 | Ca(NO3)2 | KNO3 | |
| Na2SO4 • 10H2O | 87(21°C) | 74 (21°C) | 81(21°C) |
Feuchtesorption
Als weitere Angabe zur Abschätzung der Hygroskopizität von Natriumsulfaten sind in der nachstehenden Tabelle Werte für das Sorptionsverhalten des Reinsalzes und des Gemisches mit Halit bei unterschiedlichen relativen Feuchten wiedergegeben:
| Lagerungsfeuchte | 87% r.F. | 81% r.F. | 79% r.F. |
| Na2SO4 | 79 | 0 | 0 |
| Na2SO4+NaCl (1:1 molare Mischung) |
157 | 32 | 15 |
Kristallisationsdruck[Bearbeiten]
Bei der Kristallisation aus wäßriger Lösung läßt sich für Mirabilit ein Kristallisationsdruck von 7,2-8,3 N/mm2 angeben.
Hydratationsverhalten[Bearbeiten]
siehe Natriumsulfat
Analytischer Nachweis[Bearbeiten]
Mikroskopie
[Bearbeiten]
Laboruntersuchung:
Durch mikroskopische Beobachtungen des Lösungsverhaltens sind die gute Wasserlöslichkeit und Ethanolunlöslichkeit zu verifizieren. Thenardit und Mirabilit besitzen keine morphologische Charakterisitka, die bei einfachen Rekristallisationsversuchen zur Identifizierung beitragen können. Vielmehr ist eine große Bandbreite unterschiedlichster Erscheinungsformen beobachtbar.
Brechungsindizes: nx = 1,395; ny =1,396-1,410; nz =1,398-1,419
Doppelbrechung: Δ = 0.04-0,023
Kristallklasse: monoklin
Polarisationsmikroskopische Untersuchung:
In Abhängigkeit von den vorliegenden Luftfeuchte- und Temperaturbedingungen verändern Kristalle des Rohprobematerials und des rekristallisierten Präparates ihren Kristallwassergehalt. An trockener Luft (mit r.F. < 80% bei Raumtemperatur) verliert Mirabilit sein Kristallwasser und geht in Thenardit über. Dieser Vorgang kann mikroskopisch klar nachvollzogen werden, wenn der Prozeß der Rekristallisation beobachtet wird. Mirabilit weist charakteristische anormale Interferenzfarbe auf, im Zuge des Wasserverlustes und Entstehen von Thenardit schwächen sich die anormalen Interferenzphänomene zunehmend ab.
Verwechslungsmöglichkeiten:
Generell ist die Unterscheidung einer bestimmten Anzahl von Sulfaten (die unten aufgelistet sind und wozu Thenardit zählt) ohne mikrochemische Bestimmung der Kationen problematisch, da die Brechungsindizes der Salze dicht beieinander liegen, und alle Salze eine niedrige Doppelbrechung aufweisen. Hilfreich ist die Verwendung eines Immersionsmittels mit einem nD-Wert von 1,48. Eine Differenzierung innerhalb dieser Gruppe wird damit möglich. Außerdem können die unten genannten Eigenschaften als Abgrenzungskriterien hinzugezogen werden.
Eindeutig bestimmbar wird Thenardit durch die Möglichkeit, nach Auflösung des Probematerials im Zuge der Rekristallisation das Phänomen anormaler Interferezfarben beobachten zu können, sprich Mirabilit in der hohen Hydratstufe zu identifizieren, und somit indirekt Thenardit nachzuweisen.
| Salzphase | Unterscheidungsmerkmale |
| Boussingaultit (NH4)2Mg(SO)4 • 6H20 | keine anormalen Interferenzfarben / schiefe Auslöschung |
| Pikromerit K2Mg(SO4)2 • 6H20 | keine anormalen Interferenzfarben / schiefe Auslöschung |
| Bloedit Na2Mg(SO4)2 • 6H20 | alle Indizes >1,48 / keine anormalen Interferenzfarben / schiefe Auslöschung / optisch negativ orientiert |
| Glaserit K3Na(SO4)2 | alle Indizes >1,48 / keine anormalen Interferenzfarben/schiefe Auslöschung |
| Arkanit K2SO4 | alle Indizes >1,48 / keine anormalen Interferenzfarben |
| Magnesiumformiat Mg(HCO2)2 • 2H2O | vergleichsweise hohe Doppelbrechung / keine anormalen Interfernzfarben / schiefe Auslöschung |
Betrachtung von Mischsystemen:
Mischsystem Na+– Ca2+– SO4 2-: Der Ausfall von Gips erfolgt im Zuge der Rekristallisation entsprechend der geringeren Löslichkeit desselben zuerst. Der charakteristische nadelige Habitus von einzelnen Gipskristallen wie auch von Aggregaten bleibt bestehen. Der Ausfall von Natriumsulfat erfolgt später, das eigentliche Kristallwachstum vollzieht sich merklich schneller. Die Morphologie ist unspezifisch.
Mischsystem Na+– SO4 2-– Cl-: Der Ausfall der beiden Partikelsorten beginnt etwa zeitgleich. Halit mit charakteristischer Morphologie, Natriumsulfat in extrem variierender Gestalt.
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
- Natriumsulfatktistakkisation/Mirabilit ziwschen zwei Objektträgern
Unter dem Rasterelektronenmikroskop[Bearbeiten]
Einzelnachweise[Bearbeiten]
- ↑ http://webmineral.com/data/Mirabilite.shtml gesehen 29.07.2010
- ↑ http://www.mindat.org/min-2725.html gesehen 29.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Mirabilit gesehen 29.07.2010
Literatur[Bearbeiten]
| [Dana:1951] | Dana E.S. (Hrsg.) Dana J.D. (1951): Dana's System of Mineralogy, 7, Wiley & Sons |  |
| [Robie.etal:1978] | Robie R.A., Hemingway B.S.; Fisher J.A. (1978): Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures. In: U.S. Geol. Surv. Bull, 1452 () |  |
| [Steiger.etal] | Der Eintrag existiert noch nicht. | |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Webadresse, https://doi.org/10.1016/j.gca.2008.05.053 |  |
| [Vogt.etal:1993] | Vogt, R.; Goretzki, Lothar (1993): Der Einfluss hygroskopischer Salze auf die Gleichgewichtsfeuchte und Trocknung anorganischer Baustoffe, unveröffentlichter Bericht. |  |

