Gips: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (114 dazwischenliegende Versionen von 8 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autoren: [[Benutzer:Hschwarz|Hans-Jürgen Schwarz ]], [[user:NMainusch|Nils Mainusch]], [[Benutzer:TMueller|Tim Müller]] | |||
<br> zurück zu [[Sulfate]] | |||
Gips | {{Infobox_Salz | ||
|Footnote=<ref>http://webmineral.com/data/Gypsum.shtml gesehen 30.07.2010</ref><ref>http://www.mindat.org/min-1784.html gesehen 30.07.2010</ref><ref>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Gips gesehen 30.07.2010</ref> | |||
|bild =[[Datei:SA101 1.jpeg|300px]] | |||
|mineralogischerName=Gips, Selenit | |||
|chemischerName =Calciumsulfatdihydrat | |||
|Trivialname =Leichtspat, Marienglas, Fraueneis, Alabaster | |||
|chemFormel =CaSO<sub>4</sub>•2 H<sub>2</sub>O | |||
|Hydratformen =CaSO<sub>4</sub> ([[Anhydrit ]]) <br> CaSO<sub>4</sub>•0,5 H<sub>2</sub>O ([[Bassanit]]) | |||
|Kristallsystem =monoklin | |||
|Deliqueszenzfeuchte = | |||
|Löslichkeit=2,14 g/l | |||
|Dichte =2,31 g/cm³ | |||
|Molvolumen =74,69 cm<sup>3</sup>/mol | |||
|Molgewicht =172,17g /mol | |||
|Transparenz =durchsichtig bis undurchsichtig | |||
|Spaltbarkeit =sehr vollkommen, deutlich mit Faserbildung | |||
|Kristallhabitus =tafelige, prismatische, nadelige Kristalle; körnige, massige Aggregate | |||
|Zwillingsbildung =häufig; Schwalbenschwanz, Montmartre, Durchdringung | |||
|Brechungsindices =n<sub>x</sub> = 1,5207 <br>n<sub>y</sub> = 1,5230 <br> n<sub>z</sub> = 1,5299 | |||
|Doppelbrechung =Δ = 0,0092 | |||
|optOrientierung=zweiachsig positiv | |||
|Pleochroismus =farblos | |||
|Dispersion =58° | |||
|Phasenübergang = | |||
|chemVerhalten =in Wasser schwer löslich | |||
|Bemerkungen =schlecht wasserlöslich | |||
|Literatur = <bib id="Robie.etal:1978"/> <bib id="Dana:1951"/> | |||
}} | |||
= | =Calciumsulfate und Gips = | ||
__TOC__ | |||
= | <br><br> | ||
== Abstract == | |||
An dieser Stelle wird das System CaSO<sub>4</sub>/H<sub>2</sub>O behandelt und im Speziellen auf Gips eingegangen. Gips ist eines der wichtigsten Salze, die an z. B. Bauwerken und Wandmalereien für Schäden verantwortlich sind. Vor allem außen exponierte Objekte leiden unter Gipsschäden. Die Eigenschaften, die Schadenswirkung, das Vorkommen und auch der Nachweis von Gips werden behandelt. Abbildungen, Mikroaufnahmen und Beispiele aus der Praxis ergänzen und veranschaulichen das Dargelegte.<br> | |||
== Einleitung == | |||
<br> | Gips ist eines der heute am häufigsten vorkommenden bauschädlichen Salze. Er kommt in unterschiedlichen Formen und Ausprägungen an fast allen Objekten am Außenbau vor. Auch in Innenräumen ist er häufig zu finden.<br> | ||
== Vorkommen von Gips | == Vorkommen von Gips == | ||
Als eines der am meisten verbreiteten Minerale entsteht Gips beim Ausfall aus wässrigen Lösungen bei Temperaturen unter ca. 40°C. Liegen erhöhte Temperaturen (> 60°C) einer Lösung vor, so wird direkt Anhydrit gebildet. In Form von Gesteinen sind beide Calciumsulfatformen häufig anzutreffen. Natürliche Vorkommen des Halbhydrates existieren nicht. <br> | Als eines der am meisten verbreiteten Minerale entsteht Gips beim Ausfall aus wässrigen Lösungen bei Temperaturen unter ca. 40°C. Liegen erhöhte Temperaturen (> 60°C) einer Lösung vor, so wird direkt Anhydrit gebildet. In Form von Gesteinen sind beide Calciumsulfatformen häufig anzutreffen. Natürliche Vorkommen des Halbhydrates existieren nicht. <br> | ||
Gips findet sich als Vorkommen in Salzlagerstätten und in Salzwüsten, wo durch den Einschluss von Quarzpartikeln bei der | Gips findet sich als Vorkommen in Salzlagerstätten und in Salzwüsten, wo durch den Einschluss von Quarzpartikeln bei der Bildung des Kristalls häufig sogenannte Wüstenrosen entstehen. In Salzlagerstätten bilden Gips und Anhydrit zuweilen einen "Salzhut" aus, d.h. eine mächtige Materialschicht, die sich über anderen Salzvorkommen eines natürlichen Lagers befindet. Künstlich hergestellter Gips entsteht u.a. im Zuge der Entschwefelung von Rauchgasen in Kraftwerken, in denen fossile Brennstoffe verwertet werden. | ||
== Herkunft und Bildung von Gips an Baudenkmalen == | == Herkunft und Bildung von Gips an Baudenkmalen == | ||
Die hohe Schadensrelevanz von Gips für Denkmale aus mineralischer Bausubstanz steht wesentlich in Zusammenhang mit der Umwandlungsreaktion Kalk zu Gips. Unter der Einwirkung von SO<sub>x</sub>-haltiger Luft in Verbindung mit Feuchte können auf diese Weise wichtige | Die hohe Schadensrelevanz von Gips für Denkmale aus mineralischer Bausubstanz steht wesentlich in Zusammenhang mit der Umwandlungsreaktion von Kalk zu Gips. Unter der Einwirkung von SO<sub>x</sub>-haltiger Luft in Verbindung mit Feuchte können auf diese Weise wichtige Materialkomponenten von Bauwerken (Kalkmörtel, Verputz, calcitische Gesteine etc.) zu Gips entsprechend dem Chemismus: | ||
CaCO<sub>3</sub> + H<sub>2</sub>SO<sub>4</sub> → CaSO<sub>4</sub> + H<sub>2</sub>O + CO<sub>2</sub> | CaCO<sub>3</sub> + H<sub>2</sub>SO<sub>4</sub> → CaSO<sub>4</sub> + H<sub>2</sub>O + CO<sub>2</sub> | ||
umgewandelt werden. Gips stellt | umgewandelt werden. Gips stellt darüber hinaus einen wichtigen Baustoff für die Erstellung von Mörtel und Verputzen dar und kann bereits als Gestein und somit originäres Baumaterial Eingang in das Gefüge eines Denkmals gefunden haben. Ähnliches gilt für Anhydrit. | ||
<br clear=all> | |||
== Schadenspotential und Verwitterungsaktivität == | |||
= | === Lösungsverhalten === | ||
[[File:CaSO4-Steiger-1.jpg|thumb|350px|right|'''Abbildung 1:''' Löslichkeit von CaSO4 in Wasser, Grafik M. Steiger]] | |||
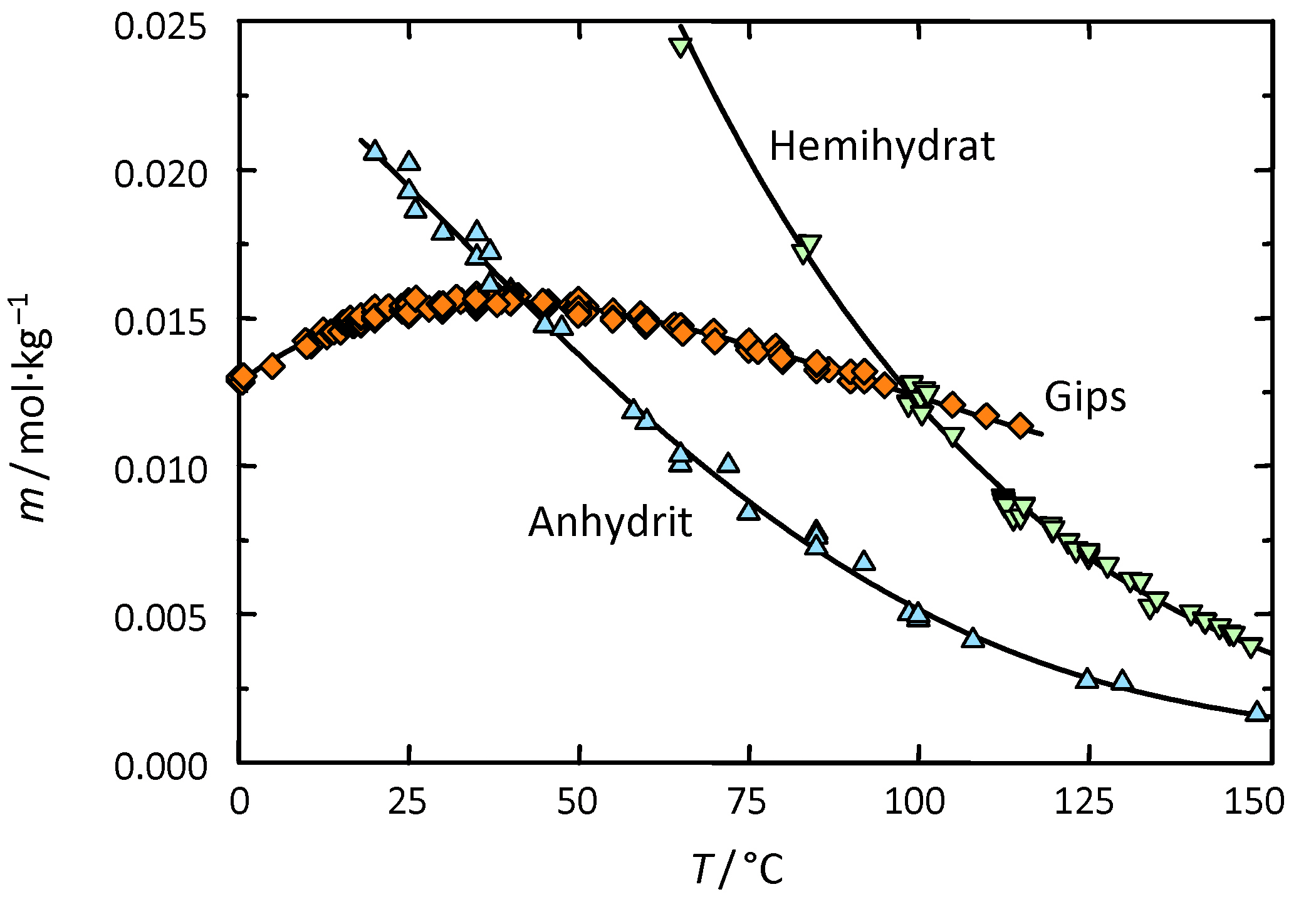
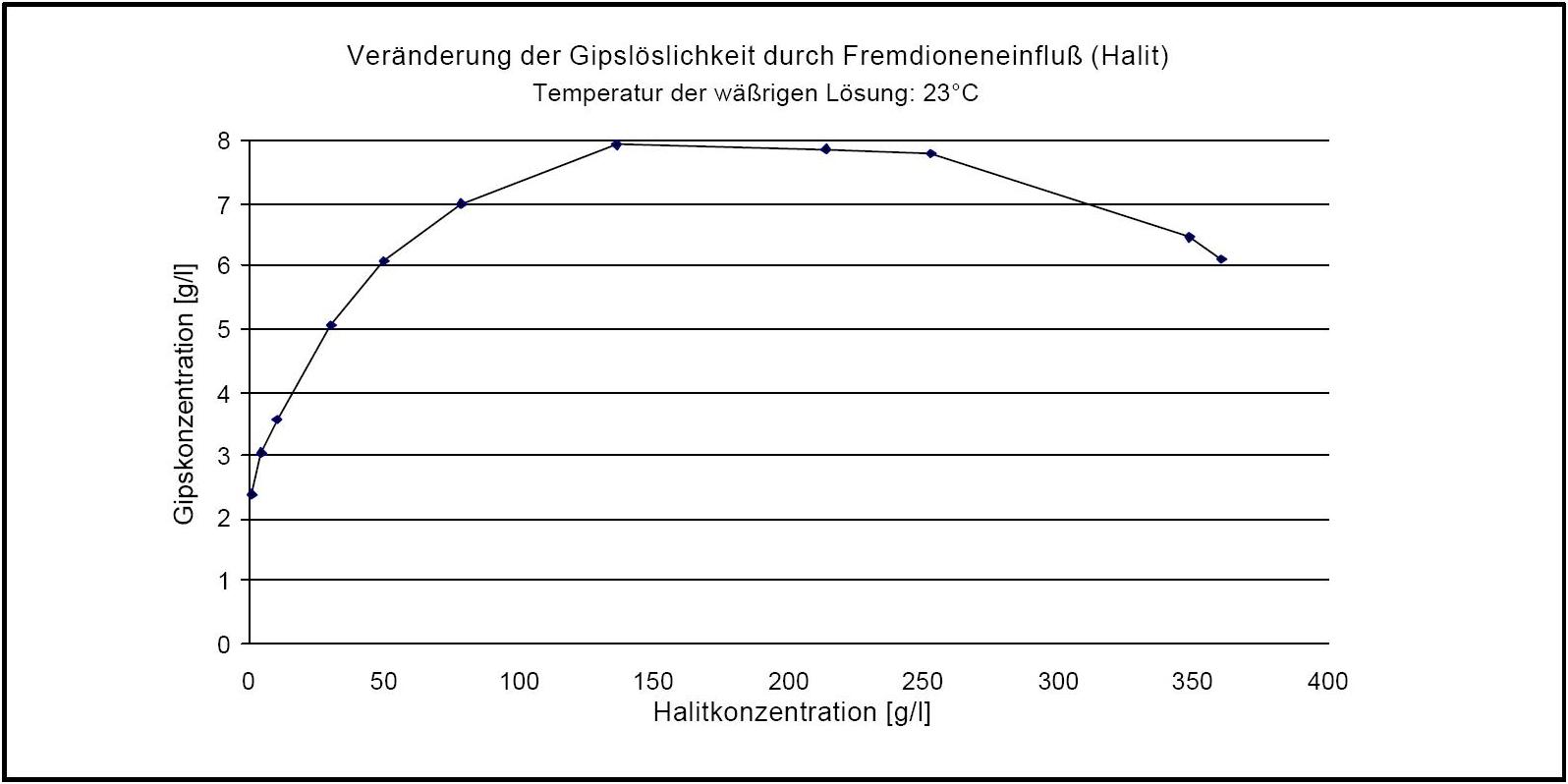
Gips zählt zur Gruppe der "gering" | Gips zählt zur Gruppe der "gering" wasserlöslichen Salze und kann somit als wenig mobil bezeichnet werden. Allerdings ist der Fremdioneneinfluss auf die Gipslöslichkeit vergleichsweise groß. So wird die Löslichkeit von Gips durch Halit je nach Konzentrationsverhältnis bis um den Faktor vier erhöht (siehe Abb. 3) | ||
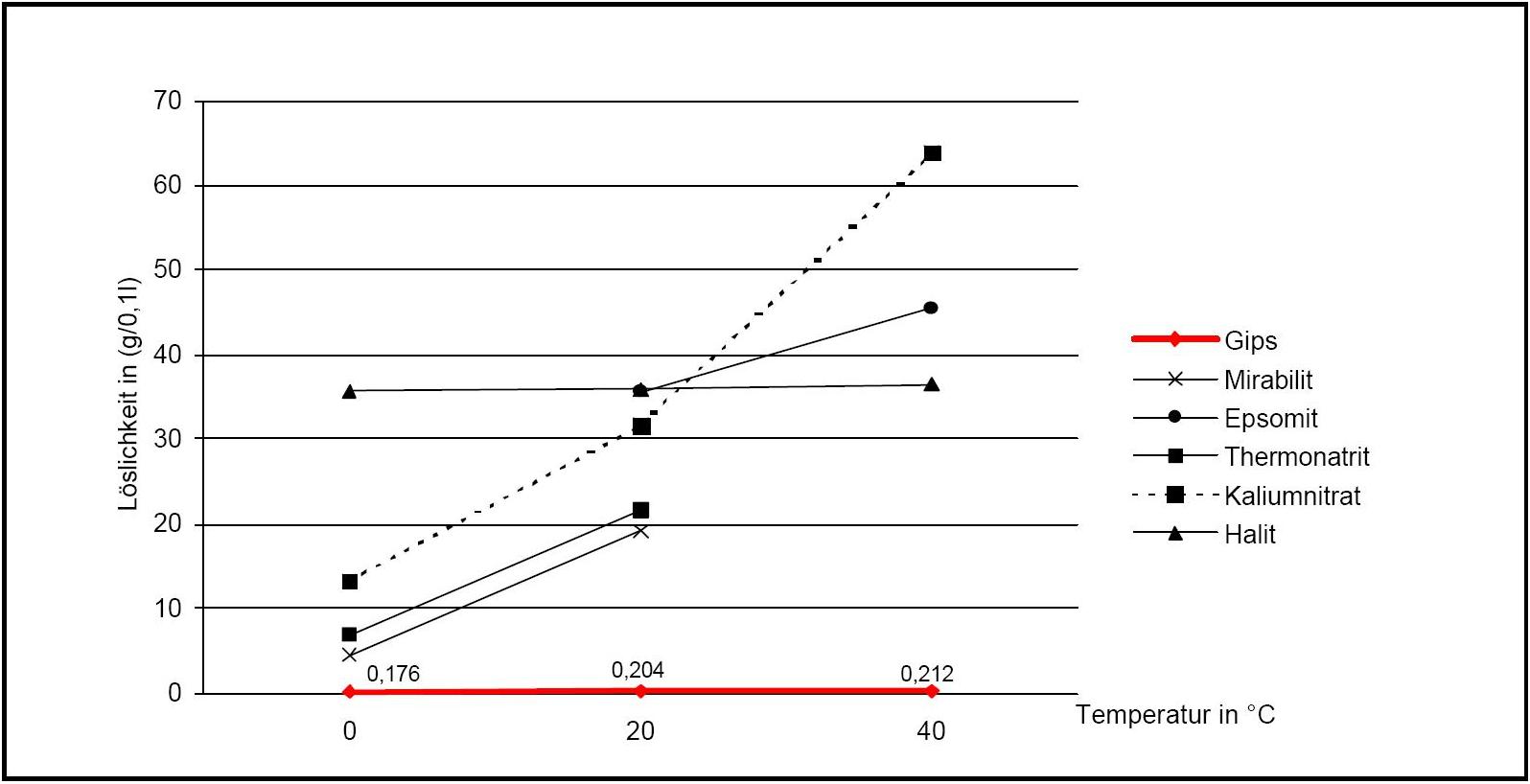
[[ | [[Datei:Loeslichkeit Gips 02.JPG|thumb|right|350px|'''Abbildung 2:'''Darstellung der temperaturabhängigen Veränderung der Löslichkeit von Gips im Vergleich mit anderen Salzphasen (Angaben nach <bib id="Stark.etal:1996"/>)]] | ||
=== Hydratationsverhalten === | |||
Das System CaSO<sub>4 </sub>– H<sub>2</sub>O: <br> Calciumsulfat kann in drei unterschiedlichen Hydratstufen auftreten, dem oben bezeichneten kristallwasserlosen Anhydrit, einem Halbhydrat, welches unter Normalbedingungen die instabilste Form darstellt, und Gips. Anhydrit existiert in verschiedenen Modifikationen, wodurch je nach Abhängigkeit der Modifikation des vorliegenden Anhydrit unterschiedliche chemische Eigenschaften (z.B. variierende Löslichkeit in Wasser) feststellbar sind. Das gleiche gilt auch für die Modifikationen des Halbhydrates (siehe Abb. 1). <br> | |||
Als Wert für die Übergangstemperatur (in wässriger Lösung) kann der Bereich 40°C-66°C angegeben werden. Unter normalen Klimabedingungen an Denkmalen entsteht somit beim Ausfall von Calciumsulfat aus einer wässrigen Lösung in erster Linie Gips. Liegen die Temperatur einer Lösung höher als 40°C-60°C, bildet sich v.a. Anhydrit. Parallel hierzu kommt es zur Bildung des Halbhydrates, welches zwar metastabil ist, beim Ausfall aber zunächst in großer Menge auftritt und dann in eine der stabileren Hydratstufen umgebildet wird. <br> | |||
Beim Erhitzen des Dihydrates (als Feststoff in Abwesenheit von wässrigem Lösungsmittel) kommt es bei einer Temperatur ab etwa 50°C zum Austreiben von Kristallwasser und es entsteht das Halbhydrat. Die vollständige Überführung zum Halbhydrat findet erst bei Temperaturen von ca. 100°C statt. Wird das Dihydrat längere Zeit auf 500-600°C erhitzt, liegt völlig entwässertes Calciumsulfat vor. Bei Temperaturen über 1000°C erfolgt die Zersetzung in Calciumoxid und SO<sub>3</sub> (siehe Abb. 2). | |||
== Hygroskopizität == | === Hygroskopizität === | ||
Gips besitzt als Reinsalz keinen definierten und durch die relative Feuchte beeinflussten Deliqueszenzpunkt. Bei Überschreiten von 90 % r.F. kann es in Gegenwart von Halit allerdings (durch die Feuchtesorption von Halit) zum Auflösen von Gipskristallen kommen; ein Absinken der Feuchtewerte auf ca.75 % r.F. bewirkt die Rekristallisation des Gipses | [[Datei:Veraenderung Loeslichkeit durch Fremdionen Gips .JPG|thumb|right|350px|'''Abbildung 3''': Dargestellt ist die Veränderung der Löslichkeit von Gips in Wasser unter Anwesenheit von [[Halit]] Liegt Halit in einer Konzentration von ca. 140 g/l in wässriger Lösung vor, so lösen sich hierin etwa 8 g Gips (Angaben nach <bib id="DAns:1933"/>)]] | ||
Gips besitzt als Reinsalz keinen definierten und durch die relative Feuchte beeinflussten Deliqueszenzpunkt. Bei Überschreiten von 90 % r.F. kann es in Gegenwart von [[Halit]] allerdings (durch die Feuchtesorption von [[Halit]]) zum Auflösen von Gipskristallen kommen; ein Absinken der Feuchtewerte auf ca.75 % r.F. bewirkt die Rekristallisation des Gipses. | |||
== Kristallisationsdruck == | === Kristallisationsdruck === | ||
Bei der Kristallisation aus | Bei der Kristallisation aus wässriger Lösung, die eine Übersättigung im Verhältnis 2:1 aufweist, läßt sich für Gips ein linearer Wachstumsdruck von 28,2-33,4 N/mm<sup>2</sup> im Temperaturbereich 0-50°C angeben. Im Vergleich mit anderen bauschädlichen Salzen liegen diese Werte im mittleren Bereich einer berechneten Werteskala, die insgesamt von 7,2 bis 65,4 N/mm<sup>2</sup> reicht [nach <bib id="Winkler:1975"/>]. | ||
== | === Hydratationsdruck === | ||
An einem Objekt vorliegender Gips kann das im Kristallgitter enthaltene Kristallwasser nur bei Temperaturen ab ca. 50°C abgeben, wird also in der Regel nicht dehydrieren. Umgekehrt ist die Einlagerung von Kristallwasser bei Vorliegen von Anhydrit oder Halbhydrat an einem Denkmal aber durchaus möglich. Beide Vorgänge sind mit Volumenveränderungen (von 31,9% beim Übergang Halbhydrat-Gips) und dem Entstehen von [[Schadensmechanismen|Hydratationsdrücken]] verbunden [Zahlenwerte nach <bib id="Sperling.etal:1980"/>]. Für den Fall des Überganges Halbhydrat-Gips (Stichwort Gipstreiben) kann bei einer Temperatur im Bereich 0-20°C und einer r.F. von ca. 80% ein [[Schadensmechanismen|Hydratationsdruck]] von 114 –160 N/mm<sup>2</sup> angegeben werden, was extrem hohe Werte darstellt [nach <bib id="Stark.etal:1996"/>]. | |||
<br clear=all> | |||
An einem Objekt vorliegender Gips kann das im Kristallgitter enthaltene Kristallwasser nur bei Temperaturen ab ca. 50°C abgeben, wird also in der Regel nicht dehydrieren. Umgekehrt ist die Einlagerung von Kristallwasser bei Vorliegen von Anhydrit oder Halbhydrat an einem Denkmal aber durchaus möglich. Beide Vorgänge sind mit Volumenveränderungen (von 31,9% beim Übergang Halbhydrat-Gips) und dem Entstehen von Hydratationsdrücken verbunden [Zahlenwerte nach <bib id=Sperling:1980/> | |||
== Umwandlungsreaktionen == | == Umwandlungsreaktionen == | ||
Wie erläutert hängt der substanzgefährdende Charakter von Gips v.a. mit der Umwandlungsreaktion Calcit-Gips zusammen. Aus Calcit gebildete Gipsmoleküle besitzen ein Volumen, welches das der ursprünglichen Calcitmoleküle um etwa 100% übersteigt. In diesem Zusammenhang ist als relevanter Schadensfaktor die Veränderung der Wasserlöslichkeit zu nennen. Calcit ist mit einer Wasserlöslichkeit von ca. 0,014g/l (20°C) schwerer löslich als Gips, so dass nach Umwandlung zu Gips ein deutlich wasserempfindlicheres System vorliegt. Hingewiesen sei auf die Untersuchungen von Snethlage und Wendler [<bib id=Snethlage.etal:1998/>], die den Einfluss von Gips auf die hygrischen Längenänderungen eines bestimmten Sandsteinmaterials analysiert haben und die beobachtete Schadensbildung in erster Linie auf das veränderte Quellverhalten durch den Gipseinfluss erklären. | Wie erläutert hängt der substanzgefährdende Charakter von Gips v.a. mit der Umwandlungsreaktion Calcit-Gips zusammen. Aus Calcit gebildete Gipsmoleküle besitzen ein Volumen, welches das der ursprünglichen Calcitmoleküle um etwa 100% übersteigt. In diesem Zusammenhang ist als relevanter Schadensfaktor die Veränderung der Wasserlöslichkeit zu nennen. Calcit ist mit einer Wasserlöslichkeit von ca. 0,014g/l (20°C) schwerer löslich als Gips, so dass nach Umwandlung zu Gips ein deutlich wasserempfindlicheres System vorliegt. Hingewiesen sei auf die Untersuchungen von Snethlage und Wendler [<bib id="Snethlage.etal:1998"/>], die den Einfluss von Gips auf die hygrischen Längenänderungen eines bestimmten Sandsteinmaterials analysiert haben und die beobachtete Schadensbildung in erster Linie auf das veränderte Quellverhalten durch den Gipseinfluss erklären. | ||
<br> | |||
= Analytischer Nachweis = | == Analytischer Nachweis == | ||
==Mikrochemie== | <!-- | ||
=== Mikrochemie === | |||
--> | |||
== Mikroskopie == | === Mikroskopie === | ||
'''Laboruntersuchung:''' Gips ist gering wasserlöslich, so dass gipshaltiges Probematerial beim Versetzen mit Aquadest nur geringfügig in Lösung geht. Wird gipshaltiges Probematerial in Lösung gebracht, entstehen bei vorsichtigem Einengen des Lösungmitteltropfens im Zuge der Rekristallisation zunächst Einzelnadeln und zunehmend nadelige Gipsaggregate im Bereich des Saumes der Lösung | '''Laboruntersuchung:''' Gips ist gering wasserlöslich, so dass gipshaltiges Probematerial beim Versetzen mit Aquadest nur geringfügig in Lösung geht. Wird gipshaltiges Probematerial in Lösung gebracht, entstehen bei vorsichtigem Einengen des Lösungmitteltropfens im Zuge der Rekristallisation zunächst Einzelnadeln und zunehmend nadelige Gipsaggregate im Bereich des Saumes der Lösung (alternativ kann Probematerial mit Salzsäure versetzt werden, was ebenfalls zur Bildung von Kristallnadeln führt). Im Vergleich zu anderen Salzen, die ebenfalls nadelig rekristallisieren können wie z.B. [[Natrit|Natriumcarbonat]], weisen Gipsnadeln eine deutlich geringere Länge auf.<br> | ||
'''Brechungsindizes:''' n<sub>x</sub> = 1.521; n<sub>y</sub> =1.523; n<sub>z</sub> =1.530<br>'''Doppelbrechung''': Δ = 0.009<br>'''Kristallklass'''e: monoklin<br> | '''Brechungsindizes:''' n<sub>x</sub> = 1.521; n<sub>y</sub> =1.523; n<sub>z</sub> =1.530<br>'''Doppelbrechung''': Δ = 0.009<br>'''Kristallklass'''e: monoklin<br> | ||
'''[[Polarisationsmikroskopie|Polarisationsmikroskopische Untersuchung:]]'''<br>Außer dem typischen nadeligen Habitus von Gipskristallen (v.a. von rekristallisiertem Material) treten unterschiedliche morphologische Charakteristika auf, die bei der Identifikation von Gips hilfreich sind. Gipspartikel (in Rohprobematerial) zeigen sich häufig in Form von gerundeten Splittern und tafeligen Rhomboedern an denen deutliche, innere Spaltflächen ablesbar sind. Darüber hinaus ist das Auftreten von Zwillingsformen sowohl bei lattigen Partikeln wie auch Tafeln und Plättchen typisch für Gips. Die Zuweisung der Brechungsindizes erfolgt entsprechend der Immersionsmethode unter Verwendung von Medien mit den Indizes nD=1,518 und nD=1,53, wobei aufgrund der zumeist sehr kleinteiligen Partikel die Überprüfung des Schroeder van der Kolk- Schatten aussagekräftiger und sicherer ist, als der Becke-Linien Test. | |||
Gipskristalle gehören zur Klasse der monoklinen Kristalle, zeigen also je nach Ausrichtung des Einzelpartikels unter dem Mikroskop zum einen sowohl parallele bzw. symmetrische Auslöschung, weisen v.a. jedoch eine charakteristische schiefe Achsenstellung in der Auslöschungsposition auf. An gut ausgebildeten Kristallrhomben ist diese schiefe Auslöschung zumeist klar messbar. Von allen Calciumsulfaten ist Gips am geringsten doppelbrechend und erscheint bei gekreuzten Polarisatoren mit sehr niedrigen Interferenzfarben, die (natürlich in Abhängigkeit der vorliegenden Partikeldicke) im Bereich grau bis gelblich weiß der ersten Ordnung liegen. | |||
Gipskristalle gehören zur Klasse der monoklinen Kristalle, zeigen also je nach Ausrichtung des Einzelpartikels unter dem Mikroskop zum einen sowohl parallele | |||
<br>'''Verwechslungsmöglichkeiten:'''<br>Gips ist im dargestellten Analyseverfahren eindeutig zuweisbar, sofern die folgenden Untersuchungskriterien eindeutig geklärt sind:<br> | <br>'''Verwechslungsmöglichkeiten:'''<br>Gips ist im dargestellten Analyseverfahren eindeutig zuweisbar, sofern die folgenden Untersuchungskriterien eindeutig geklärt sind:<br> | ||
| Zeile 172: | Zeile 121: | ||
*Gipskristalle weisen eine schiefe Auslöschung auf | *Gipskristalle weisen eine schiefe Auslöschung auf | ||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="100%" align="left" class="wikitable" | |||
{| | |+''Tabelle 1: Salzphasen mit gipsähnlichen chemischen und optischen Eigenschaften'' | ||
|- | |- | ||
| '''Salzphase''' | |bgcolor = "#F0F0F0"|'''Salzphase''' | ||
| | |bgcolor = "#F0F0F0"|'''Unterscheidungsmerkmale''' | ||
|- | |- | ||
| Syngenit | |bgcolor = "#F7F7F7"|'''[[Syngenit]]''' K<sub>2</sub>Ca(SO<sub>4)</sub> • 2H<sub>2</sub>O | ||
| alle beobachtbaren Indizes < 1,518 | |bgcolor = "#FFFFEO"|alle beobachtbaren Indizes < 1,518 | ||
|- | |- | ||
| Tachyhydrit | |bgcolor = "#F7F7F7"|'''[[Tachyhydrit]]''' CaMg<sub>2</sub>Cl<sub>6</sub> • 12H<sub>2</sub>O | ||
| zumeist ein beobachtbarer Index < 1,518 / nur parallele und symmetrische Auslöschung | |bgcolor = "#FFFFEO"|zumeist ein beobachtbarer Index < 1,518 / nur parallele und symmetrische Auslöschung | ||
|- | |- | ||
| Hydromagnesit | |bgcolor = "#F7F7F7"|'''[[Hydromagnesit]]''' Mg<sub>5</sub>[OH(CO<sub>3</sub>)<sub>2</sub>]<sub>2</sub> • 4H<sub>2</sub>O | ||
| ein Index zumeist > 1,53 | |bgcolor = "#FFFFEO"|ein Index zumeist > 1,53 | ||
|} | |} | ||
<br> | |||
< | <!-- | ||
== Röntgendiffraktometrie == | == Röntgendiffraktometrie == | ||
| Zeile 201: | Zeile 150: | ||
= Umgang mit Gipsschäden = | = Umgang mit Gipsschäden = | ||
--> | |||
== | == Salze und Salzschäden im Bild == | ||
<gallery caption=" | === Am Objekt === | ||
<gallery caption="" widths="200px" heights="150px" perrow="3"> | |||
Image:Perleberg 14.04.2003 (50)-Ausschnitt.jpg|Gipsgeschädigter Ziegel, St. Jakobi Perleberg | Image:Perleberg 14.04.2003 (50)-Ausschnitt.jpg|Gipsgeschädigter Ziegel, St. Jakobi Perleberg | ||
Image:| | Image:| | ||
| Zeile 211: | Zeile 162: | ||
</gallery> | </gallery> | ||
== Unter dem Polarisationsmikrokop == | <br clear=all> | ||
=== Unter dem Polarisationsmikrokop === | |||
<gallery caption="Im Dünnschliff von Objektproben" widths="200px" heights="150px" perrow="3"> | |||
<gallery caption="Im Dünnschliff von Objektproben" widths="200px" heights=150px" perrow="3"> | |||
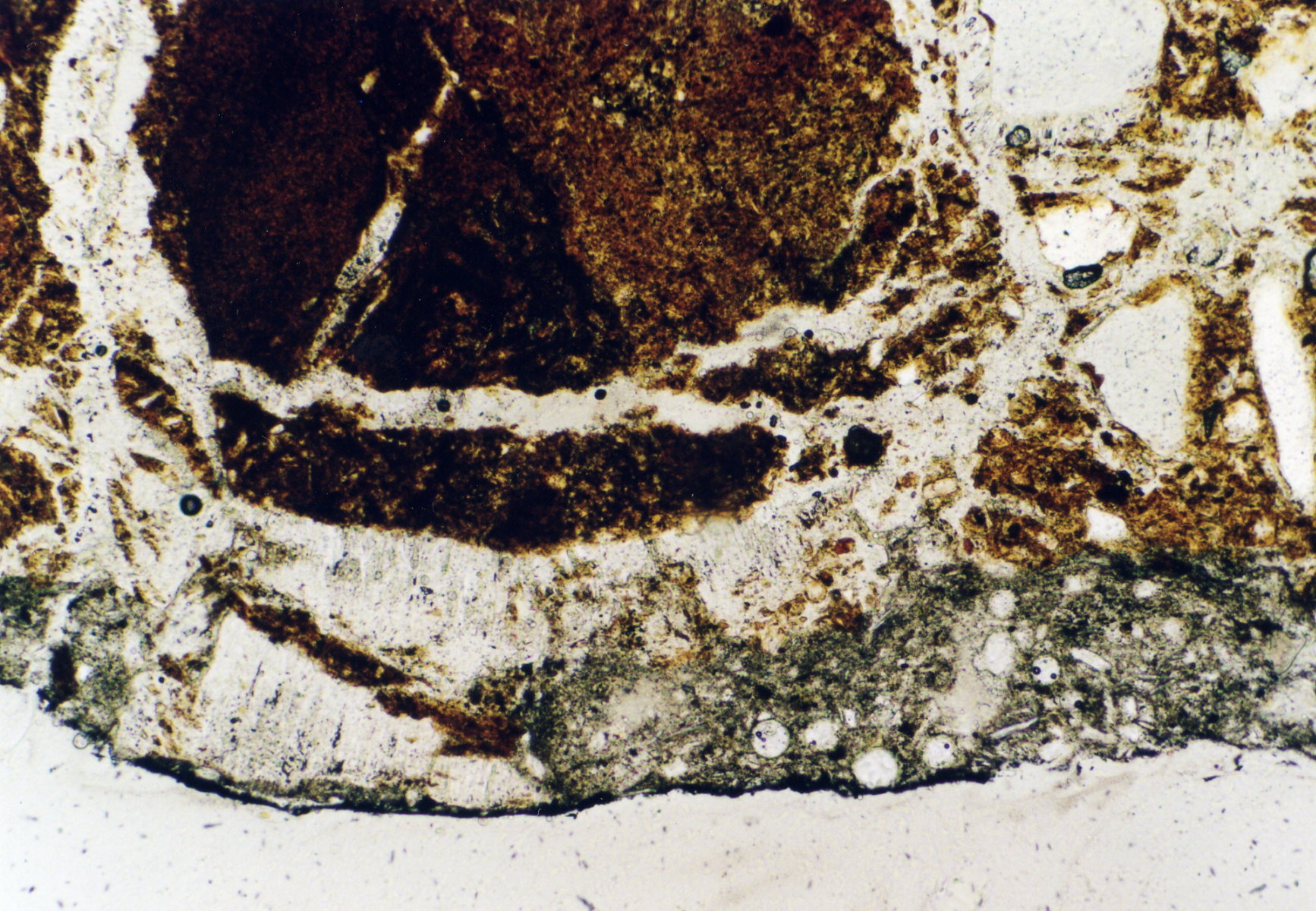
Image:Per_270603_5-13_14.jpg|Gipsgeschädigter Ziegel, St. Jakobi Perleberg | Image:Per_270603_5-13_14.jpg|Gipsgeschädigter Ziegel, St. Jakobi Perleberg | ||
Image:Per_270603_5-13_15.jpg|Gipsgeschädigter Ziegel, St. Jakobi Perleberg | Image:Per_270603_5-13_15.jpg|Gipsgeschädigter Ziegel, St. Jakobi Perleberg | ||
Image: | Image:Eilsum_Gips_duennschliff.jpg | ||
</gallery> | </gallery> | ||
== Unter dem Rasterelektronenmikroskop == | <gallery caption="Auskristallisat aus wässrigen Proben auf Objektträger" widths="200px" heights="150px" perrow="3"> | ||
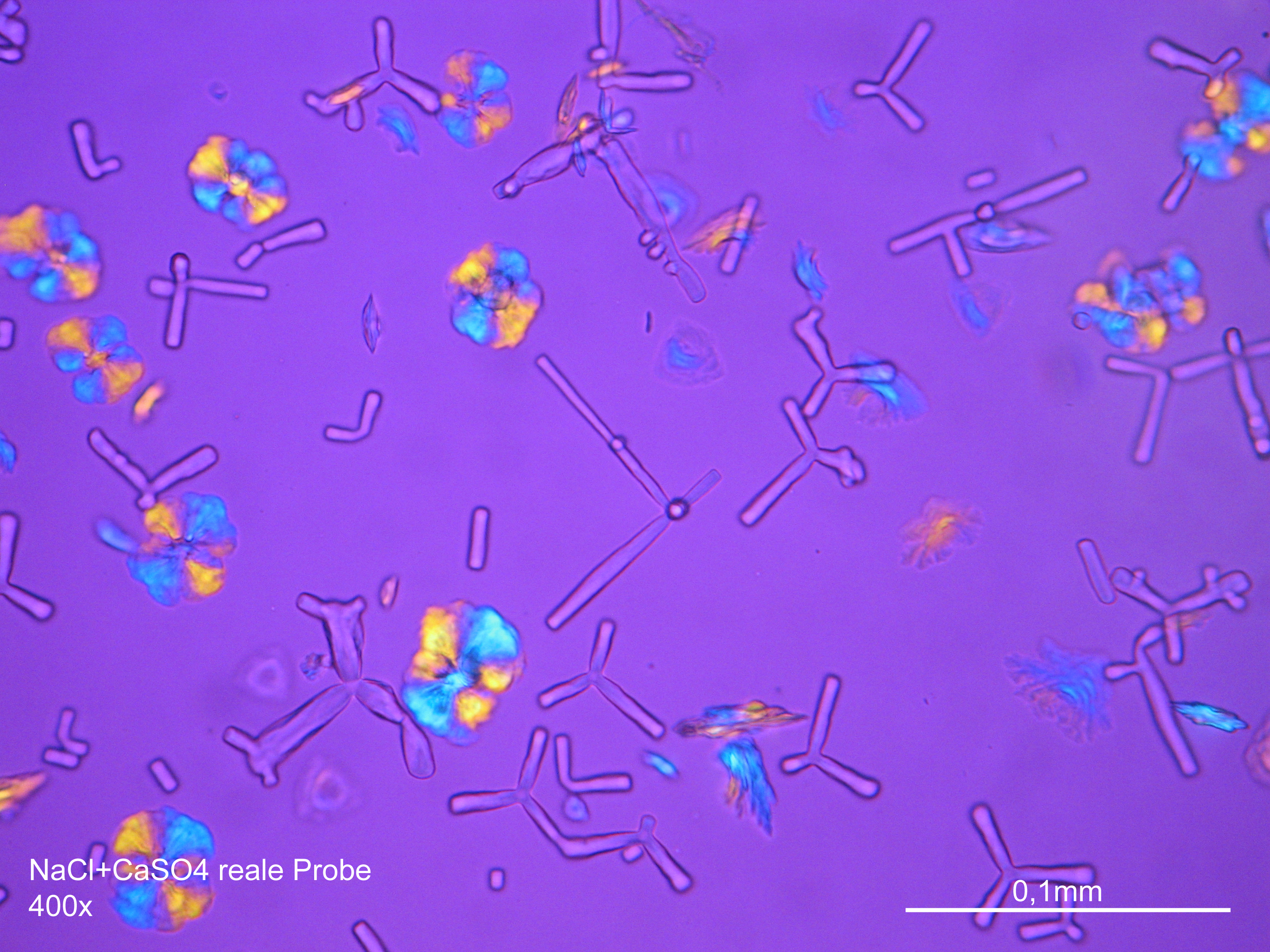
Image:CaSO4 pol 400x 01.JPG|Calciumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CaSO4+NaCl reale Probe 01.JPG|Calciumsulfat mit Natriumchlorid in realer Probe, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CaSO4+NaCl reale Probe 02.JPG|Calciumsulfat mit Natriumchlorid in realer Probe, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:HJS CaSO4 092503-1.jpg|Calciumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
</gallery> | |||
<br clear=all> | |||
=== Unter dem Rasterelektronenmikroskop === | |||
<gallery caption="Im Rasterelektronenmikoskop" widths="200px" heights="150px" perrow="3"> | <gallery caption="Im Rasterelektronenmikoskop" widths="200px" heights="150px" perrow="3"> | ||
Image: | Image:SA100_1.jpg | Gipskristalle im REM | ||
Image:SG2-2.jpeg | Gipskristalle im REM | Image:SG2-2.jpeg | Gipskristalle im REM | ||
Image:SG2- | Image:SG2-3.jpg | Gipskristalle im REM | ||
Image: | Image:SG3-SPC2.jpeg | Gipskristalle im REM | ||
Image:SG3- | Image:SG3-3.jpeg | Gipskristalle im REM | ||
Image:SG3-4.jpeg | Gipskristalle im REM | Image:SG3-4.jpeg | Gipskristalle im REM | ||
Image:SG1-5.jpeg | Gipskristalle im REM | Image:SG1-5.jpeg | Gipskristalle im REM | ||
| Zeile 238: | Zeile 197: | ||
</gallery> | </gallery> | ||
<br clear=all> | |||
= | == Einzelnachweise == | ||
<references /> | |||
== Literatur == | |||
< | <biblist/> | ||
'''Weitere Literatur''' | |||
<bibprint/> | <bibprint filter=" title:%gypsum%"/> | ||
[[Category:Gips]][[Category: | [[Category:Gips]][[Category:Schwarz,Hans-Jürgen]][[Category:R-MSteiger]][[Category:Review]][[Kategorie:Müller,Tim]][[Category:Sulfat]] [[Category:Salz]][[Category:Liste]] | ||
Aktuelle Version vom 3. Mai 2023, 11:06 Uhr
Autoren: Hans-Jürgen Schwarz , Nils Mainusch, Tim Müller
zurück zu Sulfate
| Gips[1][2][3] | |

| |
| Mineralogische Salzbezeichnung | Gips, Selenit |
| Chemische Bezeichnung | Calciumsulfatdihydrat |
| Trivialname | Leichtspat, Marienglas, Fraueneis, Alabaster |
| Chemische Formel | CaSO4•2 H2O |
| Hydratformen | CaSO4 (Anhydrit ) CaSO4•0,5 H2O (Bassanit) |
| Kristallsystem | monoklin |
| Deliqueszenzfeuchte 20°C | |
| Löslichkeit(g/l) bei 20°C | 2,14 g/l |
| Dichte (g/cm³) | 2,31 g/cm³ |
| Molares Volumen | 74,69 cm3/mol |
| Molare Masse | 172,17g /mol |
| Transparenz | durchsichtig bis undurchsichtig |
| Spaltbarkeit | sehr vollkommen, deutlich mit Faserbildung |
| Kristallhabitus | tafelige, prismatische, nadelige Kristalle; körnige, massige Aggregate |
| Zwillingsbildung | häufig; Schwalbenschwanz, Montmartre, Durchdringung |
| Phasenübergang | |
| Chemisches Verhalten | in Wasser schwer löslich |
| Bemerkungen | schlecht wasserlöslich |
| Kristalloptik | |
| Brechungsindices | nx = 1,5207 ny = 1,5230 nz = 1,5299 |
| Doppelbrechung | Δ = 0,0092 |
| Optische Orientierung | zweiachsig positiv |
| Pleochroismus | farblos |
| Dispersion | 58° |
| Verwendete Literatur | |
| [Robie.etal:1978]Titel: Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures Autor / Verfasser: Robie R.A., Hemingway B.S.; Fisher J.A.  [Dana:1951]Titel: Dana's System of Mineralogy [Dana:1951]Titel: Dana's System of MineralogyAutor / Verfasser: Dana J.D. 
| |
Calciumsulfate und Gips[Bearbeiten]
Abstract[Bearbeiten]
An dieser Stelle wird das System CaSO4/H2O behandelt und im Speziellen auf Gips eingegangen. Gips ist eines der wichtigsten Salze, die an z. B. Bauwerken und Wandmalereien für Schäden verantwortlich sind. Vor allem außen exponierte Objekte leiden unter Gipsschäden. Die Eigenschaften, die Schadenswirkung, das Vorkommen und auch der Nachweis von Gips werden behandelt. Abbildungen, Mikroaufnahmen und Beispiele aus der Praxis ergänzen und veranschaulichen das Dargelegte.
Einleitung[Bearbeiten]
Gips ist eines der heute am häufigsten vorkommenden bauschädlichen Salze. Er kommt in unterschiedlichen Formen und Ausprägungen an fast allen Objekten am Außenbau vor. Auch in Innenräumen ist er häufig zu finden.
Vorkommen von Gips[Bearbeiten]
Als eines der am meisten verbreiteten Minerale entsteht Gips beim Ausfall aus wässrigen Lösungen bei Temperaturen unter ca. 40°C. Liegen erhöhte Temperaturen (> 60°C) einer Lösung vor, so wird direkt Anhydrit gebildet. In Form von Gesteinen sind beide Calciumsulfatformen häufig anzutreffen. Natürliche Vorkommen des Halbhydrates existieren nicht.
Gips findet sich als Vorkommen in Salzlagerstätten und in Salzwüsten, wo durch den Einschluss von Quarzpartikeln bei der Bildung des Kristalls häufig sogenannte Wüstenrosen entstehen. In Salzlagerstätten bilden Gips und Anhydrit zuweilen einen "Salzhut" aus, d.h. eine mächtige Materialschicht, die sich über anderen Salzvorkommen eines natürlichen Lagers befindet. Künstlich hergestellter Gips entsteht u.a. im Zuge der Entschwefelung von Rauchgasen in Kraftwerken, in denen fossile Brennstoffe verwertet werden.
Herkunft und Bildung von Gips an Baudenkmalen[Bearbeiten]
Die hohe Schadensrelevanz von Gips für Denkmale aus mineralischer Bausubstanz steht wesentlich in Zusammenhang mit der Umwandlungsreaktion von Kalk zu Gips. Unter der Einwirkung von SOx-haltiger Luft in Verbindung mit Feuchte können auf diese Weise wichtige Materialkomponenten von Bauwerken (Kalkmörtel, Verputz, calcitische Gesteine etc.) zu Gips entsprechend dem Chemismus:
CaCO3 + H2SO4 → CaSO4 + H2O + CO2
umgewandelt werden. Gips stellt darüber hinaus einen wichtigen Baustoff für die Erstellung von Mörtel und Verputzen dar und kann bereits als Gestein und somit originäres Baumaterial Eingang in das Gefüge eines Denkmals gefunden haben. Ähnliches gilt für Anhydrit.
Schadenspotential und Verwitterungsaktivität[Bearbeiten]
Lösungsverhalten[Bearbeiten]
Gips zählt zur Gruppe der "gering" wasserlöslichen Salze und kann somit als wenig mobil bezeichnet werden. Allerdings ist der Fremdioneneinfluss auf die Gipslöslichkeit vergleichsweise groß. So wird die Löslichkeit von Gips durch Halit je nach Konzentrationsverhältnis bis um den Faktor vier erhöht (siehe Abb. 3)
Autor / Verfasser: Stark, Jochen; Stürmer, Sylvia
 )
)Hydratationsverhalten[Bearbeiten]
Das System CaSO4 – H2O:
Calciumsulfat kann in drei unterschiedlichen Hydratstufen auftreten, dem oben bezeichneten kristallwasserlosen Anhydrit, einem Halbhydrat, welches unter Normalbedingungen die instabilste Form darstellt, und Gips. Anhydrit existiert in verschiedenen Modifikationen, wodurch je nach Abhängigkeit der Modifikation des vorliegenden Anhydrit unterschiedliche chemische Eigenschaften (z.B. variierende Löslichkeit in Wasser) feststellbar sind. Das gleiche gilt auch für die Modifikationen des Halbhydrates (siehe Abb. 1).
Als Wert für die Übergangstemperatur (in wässriger Lösung) kann der Bereich 40°C-66°C angegeben werden. Unter normalen Klimabedingungen an Denkmalen entsteht somit beim Ausfall von Calciumsulfat aus einer wässrigen Lösung in erster Linie Gips. Liegen die Temperatur einer Lösung höher als 40°C-60°C, bildet sich v.a. Anhydrit. Parallel hierzu kommt es zur Bildung des Halbhydrates, welches zwar metastabil ist, beim Ausfall aber zunächst in großer Menge auftritt und dann in eine der stabileren Hydratstufen umgebildet wird.
Beim Erhitzen des Dihydrates (als Feststoff in Abwesenheit von wässrigem Lösungsmittel) kommt es bei einer Temperatur ab etwa 50°C zum Austreiben von Kristallwasser und es entsteht das Halbhydrat. Die vollständige Überführung zum Halbhydrat findet erst bei Temperaturen von ca. 100°C statt. Wird das Dihydrat längere Zeit auf 500-600°C erhitzt, liegt völlig entwässertes Calciumsulfat vor. Bei Temperaturen über 1000°C erfolgt die Zersetzung in Calciumoxid und SO3 (siehe Abb. 2).
Hygroskopizität[Bearbeiten]
Autor / Verfasser: d'Ans, J.
 )
)Gips besitzt als Reinsalz keinen definierten und durch die relative Feuchte beeinflussten Deliqueszenzpunkt. Bei Überschreiten von 90 % r.F. kann es in Gegenwart von Halit allerdings (durch die Feuchtesorption von Halit) zum Auflösen von Gipskristallen kommen; ein Absinken der Feuchtewerte auf ca.75 % r.F. bewirkt die Rekristallisation des Gipses.
Kristallisationsdruck[Bearbeiten]
Bei der Kristallisation aus wässriger Lösung, die eine Übersättigung im Verhältnis 2:1 aufweist, läßt sich für Gips ein linearer Wachstumsdruck von 28,2-33,4 N/mm2 im Temperaturbereich 0-50°C angeben. Im Vergleich mit anderen bauschädlichen Salzen liegen diese Werte im mittleren Bereich einer berechneten Werteskala, die insgesamt von 7,2 bis 65,4 N/mm2 reicht [nach [Winkler:1975]Titel: Stone: Properties, Durability in Man ´s Environment
Autor / Verfasser: Winkler, Erhard M. ].
].
Hydratationsdruck[Bearbeiten]
An einem Objekt vorliegender Gips kann das im Kristallgitter enthaltene Kristallwasser nur bei Temperaturen ab ca. 50°C abgeben, wird also in der Regel nicht dehydrieren. Umgekehrt ist die Einlagerung von Kristallwasser bei Vorliegen von Anhydrit oder Halbhydrat an einem Denkmal aber durchaus möglich. Beide Vorgänge sind mit Volumenveränderungen (von 31,9% beim Übergang Halbhydrat-Gips) und dem Entstehen von Hydratationsdrücken verbunden [Zahlenwerte nach [Sperling.etal:1980]Titel: Salt Weathering on Arid Environment, I. Theoretical ConsiderationsII. Laboratory Studies
Autor / Verfasser: Sperling, C.H.B.and Cooke, R.U. ]. Für den Fall des Überganges Halbhydrat-Gips (Stichwort Gipstreiben) kann bei einer Temperatur im Bereich 0-20°C und einer r.F. von ca. 80% ein Hydratationsdruck von 114 –160 N/mm2 angegeben werden, was extrem hohe Werte darstellt [nach [Stark.etal:1996]Titel: Bauschädliche Salze
]. Für den Fall des Überganges Halbhydrat-Gips (Stichwort Gipstreiben) kann bei einer Temperatur im Bereich 0-20°C und einer r.F. von ca. 80% ein Hydratationsdruck von 114 –160 N/mm2 angegeben werden, was extrem hohe Werte darstellt [nach [Stark.etal:1996]Titel: Bauschädliche Salze
Autor / Verfasser: Stark, Jochen; Stürmer, Sylvia ].
].
Umwandlungsreaktionen[Bearbeiten]
Wie erläutert hängt der substanzgefährdende Charakter von Gips v.a. mit der Umwandlungsreaktion Calcit-Gips zusammen. Aus Calcit gebildete Gipsmoleküle besitzen ein Volumen, welches das der ursprünglichen Calcitmoleküle um etwa 100% übersteigt. In diesem Zusammenhang ist als relevanter Schadensfaktor die Veränderung der Wasserlöslichkeit zu nennen. Calcit ist mit einer Wasserlöslichkeit von ca. 0,014g/l (20°C) schwerer löslich als Gips, so dass nach Umwandlung zu Gips ein deutlich wasserempfindlicheres System vorliegt. Hingewiesen sei auf die Untersuchungen von Snethlage und Wendler [[Snethlage.etal:1998]Titel: Steinzerfall und Steinkonservierung - neueste Ergebnisse der Münchner Forschungen
Autor / Verfasser: Snethlage, Rolf; Wendler, Eberhard ], die den Einfluss von Gips auf die hygrischen Längenänderungen eines bestimmten Sandsteinmaterials analysiert haben und die beobachtete Schadensbildung in erster Linie auf das veränderte Quellverhalten durch den Gipseinfluss erklären.
], die den Einfluss von Gips auf die hygrischen Längenänderungen eines bestimmten Sandsteinmaterials analysiert haben und die beobachtete Schadensbildung in erster Linie auf das veränderte Quellverhalten durch den Gipseinfluss erklären.
Analytischer Nachweis[Bearbeiten]
Mikroskopie[Bearbeiten]
Laboruntersuchung: Gips ist gering wasserlöslich, so dass gipshaltiges Probematerial beim Versetzen mit Aquadest nur geringfügig in Lösung geht. Wird gipshaltiges Probematerial in Lösung gebracht, entstehen bei vorsichtigem Einengen des Lösungmitteltropfens im Zuge der Rekristallisation zunächst Einzelnadeln und zunehmend nadelige Gipsaggregate im Bereich des Saumes der Lösung (alternativ kann Probematerial mit Salzsäure versetzt werden, was ebenfalls zur Bildung von Kristallnadeln führt). Im Vergleich zu anderen Salzen, die ebenfalls nadelig rekristallisieren können wie z.B. Natriumcarbonat, weisen Gipsnadeln eine deutlich geringere Länge auf.
Brechungsindizes: nx = 1.521; ny =1.523; nz =1.530
Doppelbrechung: Δ = 0.009
Kristallklasse: monoklin
Polarisationsmikroskopische Untersuchung:
Außer dem typischen nadeligen Habitus von Gipskristallen (v.a. von rekristallisiertem Material) treten unterschiedliche morphologische Charakteristika auf, die bei der Identifikation von Gips hilfreich sind. Gipspartikel (in Rohprobematerial) zeigen sich häufig in Form von gerundeten Splittern und tafeligen Rhomboedern an denen deutliche, innere Spaltflächen ablesbar sind. Darüber hinaus ist das Auftreten von Zwillingsformen sowohl bei lattigen Partikeln wie auch Tafeln und Plättchen typisch für Gips. Die Zuweisung der Brechungsindizes erfolgt entsprechend der Immersionsmethode unter Verwendung von Medien mit den Indizes nD=1,518 und nD=1,53, wobei aufgrund der zumeist sehr kleinteiligen Partikel die Überprüfung des Schroeder van der Kolk- Schatten aussagekräftiger und sicherer ist, als der Becke-Linien Test.
Gipskristalle gehören zur Klasse der monoklinen Kristalle, zeigen also je nach Ausrichtung des Einzelpartikels unter dem Mikroskop zum einen sowohl parallele bzw. symmetrische Auslöschung, weisen v.a. jedoch eine charakteristische schiefe Achsenstellung in der Auslöschungsposition auf. An gut ausgebildeten Kristallrhomben ist diese schiefe Auslöschung zumeist klar messbar. Von allen Calciumsulfaten ist Gips am geringsten doppelbrechend und erscheint bei gekreuzten Polarisatoren mit sehr niedrigen Interferenzfarben, die (natürlich in Abhängigkeit der vorliegenden Partikeldicke) im Bereich grau bis gelblich weiß der ersten Ordnung liegen.
Verwechslungsmöglichkeiten:
Gips ist im dargestellten Analyseverfahren eindeutig zuweisbar, sofern die folgenden Untersuchungskriterien eindeutig geklärt sind:
- geringe Wasserlöslichkeit
- charakteristisch nadelige Morphologie bei rekristallisierten Partikeln
- alle beobachtbaren Indizes besitzen einen nD –Wert zwischen 1,518 und 1,530
- Gipskristalle besitzen eine geringe Doppelbrechung und niedrige Interferenzfarben
- Gipskristalle weisen eine schiefe Auslöschung auf
| Salzphase | Unterscheidungsmerkmale |
| Syngenit K2Ca(SO4) • 2H2O | alle beobachtbaren Indizes < 1,518 |
| Tachyhydrit CaMg2Cl6 • 12H2O | zumeist ein beobachtbarer Index < 1,518 / nur parallele und symmetrische Auslöschung |
| Hydromagnesit Mg5[OH(CO3)2]2 • 4H2O | ein Index zumeist > 1,53 |
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
- Im Dünnschliff von Objektproben
- Auskristallisat aus wässrigen Proben auf Objektträger
Unter dem Rasterelektronenmikroskop[Bearbeiten]
- Im Rasterelektronenmikoskop
Einzelnachweise[Bearbeiten]
- ↑ http://webmineral.com/data/Gypsum.shtml gesehen 30.07.2010
- ↑ http://www.mindat.org/min-1784.html gesehen 30.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Gips gesehen 30.07.2010
Literatur[Bearbeiten]
| [DAns:1933] | d'Ans, J. (1933): Die Lösungsgleichgewichte der Systeme der Salze ozeanischer Salzablagerungen, Verlagsgesellschaft für Ackerbau, M.B.H. Berlin |  |
| [Dana:1951] | Dana E.S. (Hrsg.) Dana J.D. (1951): Dana's System of Mineralogy, 7, Wiley & Sons |  |
| [Robie.etal:1978] | Robie R.A., Hemingway B.S.; Fisher J.A. (1978): Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures. In: U.S. Geol. Surv. Bull, 1452 () |  |
| [Snethlage.etal:1998] | Snethlage, Rolf; Wendler, Eberhard (1998): Steinzerfall und Steinkonservierung - neueste Ergebnisse der Münchner Forschungen. In: Münchner Geologische Hefte, A 23, Festschrift zum 65. Geburtstag von Prof. Dr. Dietrich D. Klemm, (), 177-201 |  |
| [Sperling.etal:1980] | Sperling, C.H.B.and Cooke, R.U. (1980): Salt Weathering on Arid Environment, I. Theoretical ConsiderationsII. Laboratory Studies. In: Papers in Geography, 8 () |  |
| [Stark.etal:1996] | Stark, Jochen; Stürmer, Sylvia (1996): Bauschädliche Salze, Bauhaus-Univ. Weimar |  |
| [Winkler:1975] | Winkler, Erhard M. (1975): Stone: Properties, Durability in Man ´s Environment, Springer Verlag, Wien |  |
Weitere Literatur
| [Abriel.etal:1990] | Abriel, W.; Reisdorf, K.; Pannetier, J. (1990): Dehydration reactions of gypsum - a neutron and X-ray-diffraction study. In: Journal of solid state chemistry, 85 (1), 23-30 |  |
| [Amathieu.etal:1988] | Amathieu, L.; Boistelle, R. (1988): Crystallization kinetics of gypsum from dense suspension of hemihydrate in water. In: Journal of crystal growth, 88 (2), 183-192 |  |
| [Amit:1996] | Amit, R.; Yaalon, D. H. (1996): The micromorphology of gypsum and halite in Reg soils -- The Negev Desert, Israel. In: Earth Surface Processes and Landforms, 21 (), 127-1143 |  |
| [Atlas.etal:1988] | Atlas, Ronald M.; Chowdhury, Ahad N.; Gauri, K. Lal (1988): Microbial calcification of gypsum-rock and sulfated marble. In: Studies in Conservation, 33 (3), 149-153 |  |
| [Badosa.etal:2011] | Badosa, S.; Beck, K.; Brunetaud, X.; Al-Mukhtar, M. (2011): The role of gypsum in the phenomenon of spalling of stones. In: Ionannou, Ioannis; Theodoridou, Magdalini (Hrsg.): Proceedings of the Conference "Salt Weathering on Buildings and Stone Sculptures", Limassol, Cyprus, 19.-22. Oct. 2011, 415. |   |
| [Baldin:1987] | Baldin, V. P. (1987): Molecular mechanism for the dehydration of gypsum. In: Inorganic materials, 23 (6), 902-906 |  |
| [Baldin:1991] | Baldin, V. P. (1991): Mechanism of dehydration of gypsum. In: Inorganic materials, 27 (2), 267-270 |  |
| [Bartels.etal:1989] | Bartels, H.; Follner, H. (1989): Crystal-growth and twin formation of gypsum. In: Crystal Rearch and technology, 24 (12), 1191-1196 |  |
| [Bayer.etal:1987] | Bayer, G.; Wiedemann, H. G. (1987): Displacement-reactions in gypsum and in anhydrite. In: Thermochimica Acta, 114 (1), 75-82 |  |
| [Billo:1987] | Billo, S. M. (1987): Petrology and kinetics of gypsum - anhydrite transitions. In: Journal of Petroleum Geology, 10 (1), 73-85 |  |
| [Bosbach.etal:1994] | Bosbach, D.; Rammensee, W. (1994): In situ investigation of growth and dissolution on the (010) surface of gypsum by Scanning Force Microscopy. In: Geochimica Cosmochimica Acta, 58 (2), 843-849 |  |
| [Cameron.etal:1901] | Cameron; Seidell (1901): Solubility of gypsum in aqeous solutions of certain electrolytes. In: Journal of Physical Chemistry, 5 (), 643-655 |  |
| [Canton.etal:1905] | Cantón, Y.; Pini, R.; Sol*-Benet, A.; Queralt, I. (1905): Weathering of a gypsum-calcareous mudstone under semi-arid environment at Tabernas, SE Spain: Laboratory and field-based experimental approaches. In: Catena, 44 (2), 111-132, https://doi.org/10.1016/S0341-8162(00)00153-3 |  |
| [Canton.etal:1905a] | Cantón, Y.; Pini, R.; Solé-Benet, A.; Queralt, I. (1905): Weathering of a gypsum-calcareous mudstone under semi-arid environment at Tabernas, SE Spain: Laboratory and field-based experimental approaches. In: Catena, 44 (2), 111-132 |  |
| [Foner.etal:1983] | (1983): Simple method for the determination of gypsum, with some observations on the solubilities of gypsum, anhydrite, calcite and dolomite. In: Analyst, 108 (), 615-620 |  |
| [Franchini-Angela.etal:1989] | Franchini-Angela, M.; Rinaudo, C. (1989): Influence of sodium and magnesium on the growth-morphology of gypsum, CaSO4.2H2O. In: Neues Jahrbuch fur Mineralogie, Abhandlungen, 160 (1), 105-115 |  |
| [Hassine.etal:2017] | Hassine, Mohamed Ahmed; Beck, Kévin; Brunetaud, Xavier; Al-Mukhtar, Muzahim (2017): Local strain measurements during water imbibition in tuffeau polluted by gypsum. In: Laue, Steffen (Hrsg.): Proceedings of SWBSS 2017. Fourth International Conference on Salt Weathering of Buildings and Stone Sculptures, University of Applied Sciences Potsdam, Germany, 20-22 September 2017,Verlag der Fachhochschule Potsdam 74-80, 10.5165/hawk-hhg/323. |   |
| [Klemmedson.etal:1989] | Klemmedson, J.; Rehfuess, K.; Makeschin, F.; Rodenkirchen, H. (1989): Nitrogen mineralization in lime- and gypsum-amended substrates from ameliorated acid forest soils. In: Soil Science, 147 (), 55-63 |  |
| [LalGauri.etal:1989] | Lal Gauri, K.; Chowdhury, Ahad N.; Kulshreshtha, Niraj P.; Punuru, Adinarayana R. (1989): The sulfation of marble and the treatment of gypsum crusts. In: Studies in Conservation, 34 (4), 201-6 |  |
| [Livingston:1991] | Livingston, R. (1991): The use of gypsum mortar in historic buildings. In: Brebbia, C. A.; Dominguez, J.; Escrig, F. (Hrsg.): Structural Repair and Maintenance of Historic Buildings II, Computational Mechanics Publications, 157-165. |  |
| [Livingston:1994] | Livingston, R. A. (1994): Influence of evaporite minerals on gypsum crusts and alveolar weathering. In: Fassina, V.; H, Ott; Zezza, F. (Hrsg.): The conservation of monuments in the Mediterranean Basin. Proceedings of the 3rd International Symposium, Venice, 1994,Soprintendenza ai Beni Artistici e Storici di Venezia 101-107. |  |
| [Mankin:1962] | Mankin, Charles J. (1962): Thenardite efflorescence in Permian gypsum, western Oklahoma. In: Oklahoma Geology Notes, 22 (9), 230-234 |  |
| [Neumann.etal:1997] | Neumann, Hans-Hermann; Lork, A.; Steiger, Michael; Juling, Herbert (1997): Decay patterns of weathered quarz sandstones: Evidence of gypsum induced structural changes. In: Sveinsdottir, E.L. (Hrsg.): Proceedings 6th Euroseminar on microscopy applied to building materials, Iceland Building Research Institute, 238-249. |  |
| [Ponizovskii.etal:1978] | Ponizovskii, A. A.; Pachenskii, Ya. A. (1978): Calculation of the solubility of gypsum in the five-component aqueous salt system Ca, Mg, Na Cl,SO4-H2O at 25C. In: , 24 (1), 88-92 |  |
| [Rinaudo.etal:1985] | Rinaudo, C.; Robert, M.; Lefaucheux, F. (1985): Growth and characterization of gypsum crystals. In: Journal of Crystal Growth, 71 (3), 803-806, 10.1016/0022-0248(85)90396-3 |  |
| [Rinaudo.etal:1989] | Rinaudo, C.; Franchini-Angela, M. (1989): Curvature of gypsum crystals induced by growth in the presence of impurities. In: Mineralogical magazine, 53 (372), 479-482, Webadresse, 10.1180/minmag.1989.053.372.08 |  |
| [Sassoni.etal:2017] | Sassoni, Enrico; Graziani, Gabriela; Franzoni, Elisa; Scherer, George W. (2017): Conservation of marble artifacts by phosphate treatments: influence of gypsum contamination. In: Laue, Steffen (Hrsg.): Proceedings of SWBSS 2017. Fourth International Conference on Salt Weathering of Buildings and Stone Sculptures, University of Applied Sciences Potsdam, Germany, 20-22 September 2017,Verlag der Fachhochschule Potsdam 143-149, 10.5165/hawk-hhg/331. |   |
| [Schluetter.etal:1994] | Schlütter, Frank; Juling, Herbert; Blaschke, Rochus (1994): Black skins and gypsum crystallization on terra-cotta material--microscopical investigations on samples of the Schwerin Castle. In: Fitz, Stephen (Hrsg.): NATO-CCMS pilot study "Conservation of historic brick structures:" proceedings of the 7th expert meeting, Venice, 22-24 November 1993, , 90-99. |  |
| [Seidl.etal:1969] | Seidl, Vlastimil; Knop, Osvald; Falk, Michael (1969): Infrared studies of water in crystalline hydrates: gypsum (CaSO4. 2H2O). In: Can. J. Chem, 47 (8), 1361-8 |  |
| [Siegel.etal:1968] | Siegel, Frederic R.; Dort, Wakefield Jr.; Milton, Charles (1968): Thenardite, syngenite, gypsum, and calcite caliche from Southern Victoria Land, Antarctica. In: Geol. Soc. Amer., Spec. Paper. No., 101 (201) |  |
| [Skoulikidis.etal:1984a] | Skoulikidis, Theodore N.; Beloyannis, Nicholas (1984): Inversion of marble sulfation - reconversion of gypsum films into calcite on the surfaces of monuments and statues. In: Studies in Conservation, 29 (4), 197-204, Webadresse |  |
| [Skoulikidis.etal:1990] | Skoulikidis, T.; Georgopoulou, E.; Adamopoulou, P. (1990): Oriented inversion of gypsum on the surface of ancient monuments into calcium carbonate back, 2nd ASMOSIA meating, Leuren, Belgium. |  |
| [Skoulikidis.etal:1991] | Skoulikidis, T.; Koui, M.; Kostoudi, A. (1991): A new non-destructive method to differentiate in situ marble from gypsum and CaCO3 from inversion of gypsum; use of liquid crystals. In: Molecular crystals and liquid crystals, 206 (), 117-121 |  |
| [Tanji.etal:1966] | Tanji, K. K.; Doneen, L. P. (1966): Predictions on the solubility of gypsum in aqueous salt solutions. In: Water Resources Research, 2 (), 543-548 |  |
| [Tanji:1969] | Tanji, Kenneth K. (1969): Solubility of gypsum in aqueous electrolytes as affected by ion association and ionic strengths up to 0.15 M and at 25 |  |
| [Todorovic.etal:2014] | Todorović, J.; Janssen, H. (2014): Numerical simulation of gypsum transport and crystallization. In: Hilde De Clercq (Hrsg.): Proceedings of SWBSS 2014 3rd International Conference on Salt Weathering of Buildings and Stone Sculptures,KIK-IRPA, Royal Institute for Cultural Heritage Brussels 133-149, 10.5165/hawk-hhg/273. |   |
| [VergesBelmin:1994] | Verges-Belmin, V. (1994): Pseudomorphism of gypsum after calcite, a new textural feature accounting for the marble sulphation mechanism. In: Atmospheric Environment, 28 (2), 295-304 |  |
| [Watson:1982] | Watson, A. (1982): The origin, nature and distribution of gypsum crusts. Dissertation, Pd.D. Thesis, University of Oxford |  |
| [Weijnen.etal:1987] | Weijnen, M. P. C.; Van der Leeden, M. C.; Van Rosmalen, G. M. (1987): Influence of the molecular structure of phosphonate inhibitors on various aspects of barite and gypsum crystallisation. In: Rodriguez-Clemente, R.; Tardy, Y. (Hrsg.): Geochemistry and Mineral Formation on the Earth’s Surface, CSIC, Madrid, 753-776. |  |
| [Zehnder.etal:2009] | Zehnder, K.; Schoch, O. (2009): Efflorescence of mirabilite, epsomite and gypsum traced by automated monitoring on-site. In: Journal of Cultural Heritage, 10 (3), 319-330, Webadresse, 10.1016/j.culher.2008.10.009 |  |
| [Zehnder:1993] | Zehnder, K. (1993): New aspects of decay caused by crystallization of gypsum. In: Thiel, M.-J. (Hrsg.): Proceedings of the International RILEM/UNESCO Congress on Conservation of Stone and Other Materials,London: E & F N Spon. 107-114. |  |
| [Zezza:1994] | Zezza, F. (1994): Minoan palace of Knossos: weathering of gypsum stones. In: Fassina, V.; Ott, H.; Zezza, F. (Hrsg.): The conservation of monuments in the Mediterranean Basin. Proceedings of the 3rd International Symposium, Venice, 1994,Soprintendenza ai Beni Artistici e Storici di Venezia 635-646. |  |