Kieserit
<bibimport/>
| Kieserit[1][2][3] | |

| |
| Mineralogische Salzbezeichnung | Kieserit |
| Chemische Bezeichnung | Magnesiumsulfathydrat |
| Trivialname | Bittersalz |
| Chemische Formel | Mg[SO4] • H2O |
| Hydratformen | Sanderit (MgSO4•2H2O) Starkeyit (MgSO4•4H2O) Pentahydrit (MgSO4•5H2O) Hexahydrit (MgSO4•6H2O) Epsomit (MgSO4•7H2O) Meridianit (MgSO4•11 H2O) Magnesium 12-Hydrat |
| Kristallsystem | monoklin-prismatisch |
| Deliqueszenzfeuchte 20°C | |
| Löslichkeit(g/l) bei 20°C | |
| Dichte (g/cm³) | 2,57 g/cm3 |
| Molares Volumen | 53,85 cm3/mol |
| Molare Masse | 138,9 g/mol |
| Transparenz | durchsichtig bis durchscheinend |
| Spaltbarkeit | vollkommen |
| Kristallhabitus | bipyramidale Kristalle, oft stark deformiert, körnige, massige Aggregate |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | |
| Kristalloptik | |
| Brechungsindices | nx = 1,523-1,520 ny = 1,535-1,533 nz = 1,586-1,584 |
| Doppelbrechung | Δ = 0,063-0,064 |
| Optische Orientierung | zweiachsig positiv |
| Pleochroismus | farblos |
| Dispersion | 55° |
| Verwendete Literatur | |
| {{{Literatur}}} | |
Autoren: Hans-Jürgen Schwarz, Tim Müller, NN....
zurück zu Sulfate
Abstract[Bearbeiten]
Ein Überblick über das Magnesiumsufat Kieserit wird gegeben.
Vorkommen von Kieserit[Bearbeiten]
Kieserit bildet in der Natur selten Einzelkristalle aus. Das Magnesiumsulfathydrat kommt in Lagerstätten zusammen mit Sylvin und Steinsalz vor. Diese finden sich in den Alpen und in Norddeutschland, in Italien (Vesuv), Arizona (Bisbee), Nevada und Whashington (Mt. Kruger). Häufiger kommt Epsomit als Ausblühung an Gesteinswänden magnesiumhaltiger Gesteine vor, dabei handelt es sich meist auch um Gesteine mit hohem Karbonatanteil (Calcit oder Dolomit). Außerdem bildet es sich bei dem Eindampfen von Gewässern oder als Sekundärmineral bei der Oxidation von Eisensulfiden. Ebenfalls kommt es an Oberflächen von Bauwerken vor, wo es zu gravierenden Schäden führen kann.
Angaben zu Herkunft und Bildung von Kieserit an Baudenkmalen
[Bearbeiten]
Magnesiumsulfate bilden sich an Baustoffen, sofern diese eine Quelle für Magnesiumionen darstellen. Diese können verschiedene Baustoffe bilden.
- Kalk mit dolomitischem Anteil:
Dolomit ist ein Doppelsalz, das sowohl Calcium als auch Magnesium beinhaltet. Der negative Ladungsträger wird durch Karbonation gebildet. Für die Mörtelherstellung wird Kalk verwendet, der Dolomit enthalten kann. Durch das Brennen und Löschen entstehen reine Salze (CaCO3 und MgCO3). Die Löslichkeit des Magnesits (1,76 g/l) ist deutlich höher als die des reinen Calcits (0,014 g/l) oder des Dolomits (0,078 g/l). Tritt in dem Baustoff Feuchte auf, können die Magnesiumverbindungen gelöst werden und bei dem Entzug der Feuchtigkeit wieder als Salze ausfallen. Hierbei können die Sulfate gebildet werden, insbesonders wenn durch die Verwendung gipshaltiger Produkte am selben Objekt die Sulfationen zur Verfügung gestellt werden.
CaMg[CO3]2 -> CaCO3 + MgCO3
MgCO3 + n H2O -> Mg2+ aq + CO32- aq
Mg2+ + SO42- -> MgSO4
- Magnesiabinder:
Magnesiabinder beinhaltet ebenfalls Magnesiumverbindungen, die hygroskopische Salze bilden können. Diese stellen eine Magnesiumquelle dar und können in Verbindung mit Sulfationen zu Magnesiumsulfaten umgebildet werden.
- Zement:
Auch in Zement ist Magnesium enthalten. Um Schäden vorzubeugen ist in Zement laut DIN 1164 nur ein Höchstgehalt von 5M% zugelassen, weil das Magnesium auch aus dem Zement herausgelöst werden und Sulfate bilden kann. Eine weitere Quelle für Magnesiumionen in einer Lösung kann Streusalz sein, weil dieses oft geringe Mengen von Magnesiumchlorid enthält. Des weiteren können auch Ionen aus der Bodenlösung ein Problem darstellen, sofern diese durch kapillaren Aufstieg an die Oberfläche transportiert werden.
Lösungsverhalten[Bearbeiten]
Die Wasserlöslichkeit von Kieserit ist 684 g/l bei einer Temperatur von 100 °C [Steiger und Asmussen,2008], damit zählt es, wie alle beschriebenen Magnesiumsulfathydratformen, mit einer Löslichkeit von deutlich über 100 g/l (bei 20 °C) zur Gruppe der leichtlöslichen Salze. Damit ist im Prinzip eine große Mobilität des Salzes und eine häufige Verlagerung der Anreicherungszonen im Materialgefüge verbunden. Mit dem Temperatureifluss auf die Löslichkeit kann die Gefahr eines Ausfallens gelöster Salze bei raschem Temperaturabfall verbunden sein [Mainusch:2001]Titel: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Autor / Verfasser: Mainusch, Nils ]
]
Hygroskopizität[Bearbeiten]
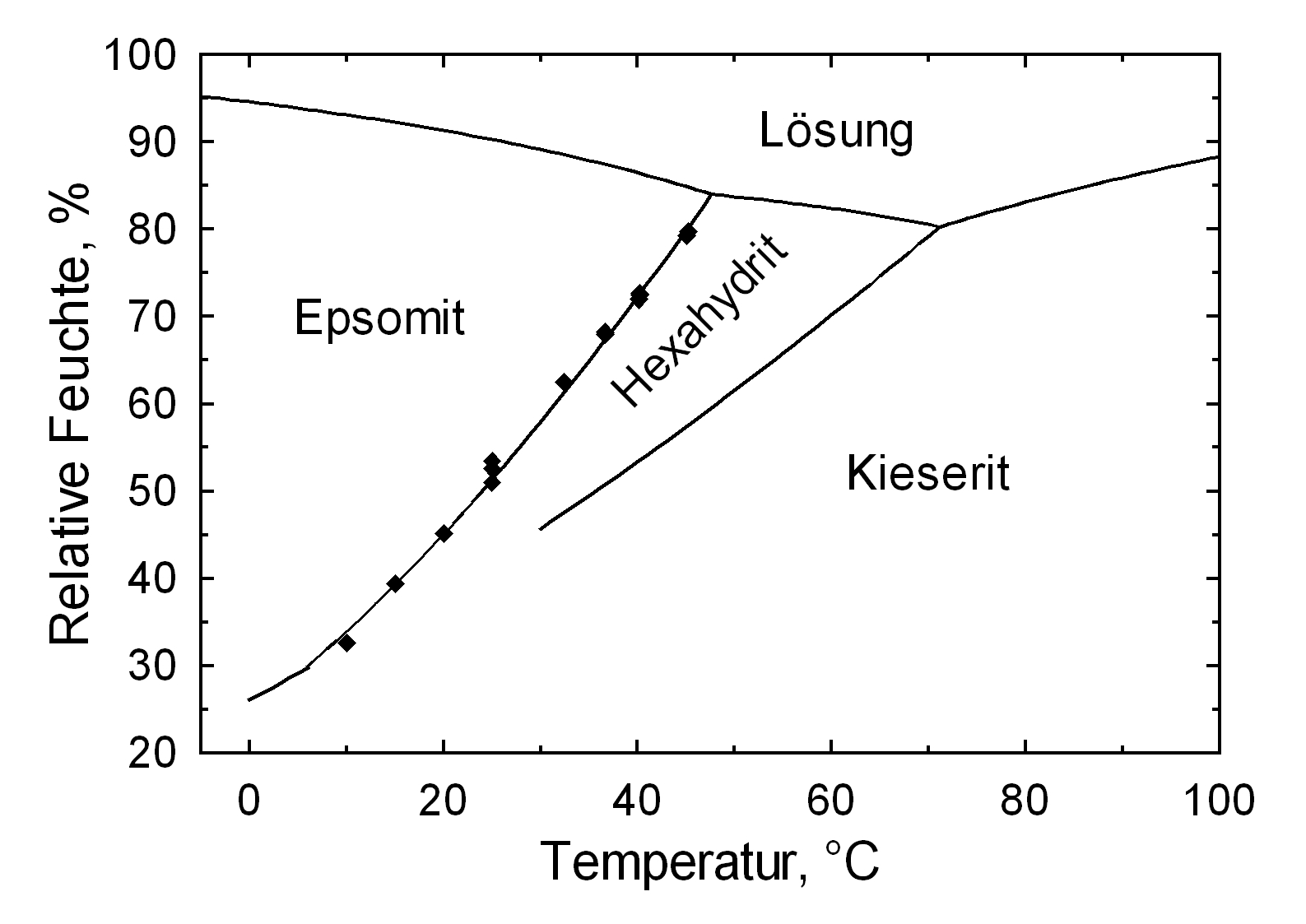
Die geringe Hygroskopizität des Reinsalzes Kieserit, die in dem hohen Wert der Gleichgewichtsfeuchte im Bereich von 42% r.F. deutlich wird, kann nicht isoliert betrachtet werden.
In Mischsystemen, d.h. unter dem Einfluss von Fremdionen, liegt der Sorptionspunnkt tiefer. Die Möglichkeit der hygroskopischen Feuchteaufnahme mit den damit verbundenen Problematiken ist trotz des hohen Deliqueszenzpunktes durchaus gegeben. [Mainusch:2001]Titel: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Autor / Verfasser: Mainusch, Nils ]
]
Hydratationsverhalten[Bearbeiten]
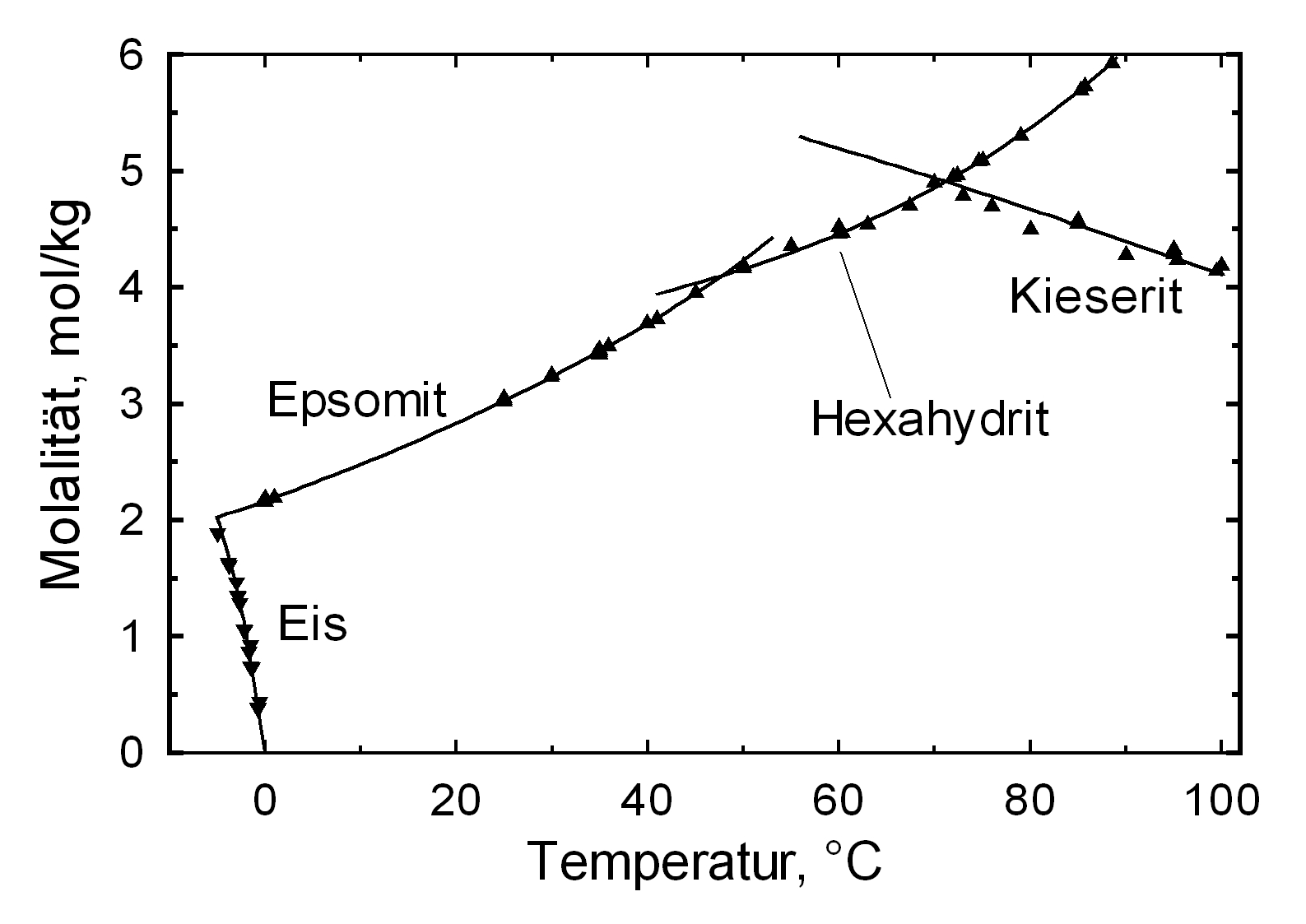
Als stabile Verbindungen sind die oben aufgelisteten sechs Hydratstufen des Magnesiumsulfates belegt. Mit der Ausnahme des Magnesiumsulfat-12-Hydrates wurden alle oben aufgeführten Kristallwasserstufen des Magnesiumsulfates an Baudenkmalen nachgewiesen, wobei im wesentlichen jedoch nur Epsomit, Hexahydrit, Pentahydrit und Kieserit auftreten.
Kieserit ist das Magnesiumsulfat Monohydrat. Es kann durch die Dehydratisierung von Magnesiumsulfathydraten entstehen. Bei der Umwandlung kommt es zu einer Volumenabnahme durch die Abgabe von Wasser. Mit zunehmender relativer Luftfeuchte nimmt auch der Hydratwassergehalt innerhalb des Magnesiumsulfates zu. Bei Raumtemperatur (25°C) ist Kieserit bis zu einer RF von ca. 42 % stabil, darüber findet die Umwandlung zu Hexahydrit oder Epsomit statt. Hexahydrit ist bis unterhalb von 51 % RF stabil, darüber bildet sich Epsomit. Die Phasenumwandlung kann direkt erfolgen oder über die Lösung und Rekristallisation. Hierbei kommt es zur metastabilen Existenz der wasserärmeren Phase bis zu ihrer Deliquiszenzfeuchte. Oberhalb dieser RF löst sich die Phase und es entsteht eine überkritische Lösung, aus der die hydratisierte Phase auskristallisiert[Steiger.etal:2008]Titel: Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke .
.
Umwandlungsreaktionen[Bearbeiten]
siehe Magnesiumsulfat
Analytischer Nachweis[Bearbeiten]
Mikrochemie[Bearbeiten]
Siehe Magnesiumsulfat
Mikroskopie[Bearbeiten]
Polarisationsmikroskopische Untersuchung:
Bei der Untersuchung mit Hilfe des Polarisationsmikroskopes ist zu beachten, dass bei normalen Raumbedingungen, einer Temperatur von ca. 20 °C und einer Relativen Luftfeuchte von ca. 40 %, Hexahydrit die stabile Phase ist. Aufgrund dessen muss für die Kristallisation vorn Kieserit das Raumklima verändert werden.
Da es sich um ein optisch anisotropes Mineral handelt, zeigt es eine Doppelbrechug bei gekreuzten Polarisatoren. Seine Interferenzfarben sind niedrig innerhalb der ersten Ordnung. Die Brechungsindizes liegen bei α=1,520 β=1,533 γ=1,584 mit einer Doppelbechung von 0,01. Die Brechungsindizes sind verglichen mit anderen Sulfaten, sowie im Vergleich mit anderen Salzen relativ hoch. Die Doppelbrechung ist bei den Sulfaten im unteren Bereich und verglichen mit Nitraten sehr niedrig.
Weblinks
[Bearbeiten]
- ↑ http://webmineral.com/data/Kieserite.shtml gesehen 29.07.2010
- ↑ http://www.mindat.org/min-2204.html gesehen 29.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Kieserit gesehen 29.07.2010
Literatur[Bearbeiten]
[Filter fehlt]