Thenardit: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 98: | Zeile 98: | ||
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumsulfat als Ausblühsalz entstehen, wenn mit schwefeligen Gasen kontaminierte Luft einwirkt oder sonstige Sulfatquellen vorliegen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch können 100 kg Portlandzement mit einem Gehalt von lediglich 0,1% löslichem Na<sub>2</sub>O in schwefelsäurehaltiger Luft 520g Mirabilit ausbilden [Angaben nach Arnold/Zehnder 1991]. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendeten Restaurierungsprodukten (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächenwasser anzuführen, die Na<sup>+</sup>-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem Natriumchlorid. In Küstennähe ist NaCl-haltiges Meerwasser als Natriumquelle zu berücksichtigen. | Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumsulfat als Ausblühsalz entstehen, wenn mit schwefeligen Gasen kontaminierte Luft einwirkt oder sonstige Sulfatquellen vorliegen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch können 100 kg Portlandzement mit einem Gehalt von lediglich 0,1% löslichem Na<sub>2</sub>O in schwefelsäurehaltiger Luft 520g Mirabilit ausbilden [Angaben nach Arnold/Zehnder 1991]. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendeten Restaurierungsprodukten (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächenwasser anzuführen, die Na<sup>+</sup>-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem Natriumchlorid. In Küstennähe ist NaCl-haltiges Meerwasser als Natriumquelle zu berücksichtigen. | ||
= Angaben zum Schadenspotential und zur Verwitterungsaktivität von | = Angaben zum Schadenspotential und zur Verwitterungsaktivität von Thenardit = | ||
== Lösungsverhalten == | == Lösungsverhalten == | ||
Die an Bauwerken auftretenden Natriumsulfate Thenardit und Mirabilit zählen zur Gruppe der leichtlöslichen und somit leicht mobilisierbaren Salzen (vgl.Tabelle [[Hygroskopizität der Salze und Gleichgewichtsfeuchte]]). Die temperaturabhängige Veränderung der Löslichkeit der Natriumsulfate ist groß. Mit dem starken Einfluß der Temperatur auf die Löslichkeit von Thenardit ist die Gefahr einer Lösungsübersättigung bei raschem Temperaturabfall und Kristallisation des Salzes verbunden.<br><br>''Diagramm 1 - Darstellung der temperaturabhängigen Veränderung der Löslichkeit von Thenardit und Mirabilit im<br>Vergleich mit anderen Salzphasen [nach Stark/Stürmer 1993].''<br> | |||
[ | == Hygroskopizität == | ||
Im unteren ist der Temperatureinfluß auf die Deliqueszenzpunkte von Thenardit und Mirabilit verdeutlicht. Auffällig sind hierbei die gegenläufigen Kurvengänge. | |||
''Diagramm 2 - Deliqueszenzpunkte der Reinsalze Thenardit und Mirabilit [nach Arnold/Zehnder 1991]''. | |||
In Anwesenheit von Fremdionen (bei Salzgemischen) verändern sich die Parameter der Gleichgewichtsfeuchte und der notwendigen Temperatur- und Feuchtebedingungen für Umkristallisationen zudem deutlich. Als orientierende Daten sind in der unteren Tabelle experimentell erfaßte Werte der Gleichgewichtsfeuchte in unterschiedlichen Salzgemischen wiedergegeben. Es zeigt sich, daß alle Werte der Gleichgewichtsfeuchte unter denen des Reinsalzes Mirabilit liegen. | |||
{| cellspacing="1" cellpadding="1" border="1" style="width: 313px; height: 65px;" | |||
|- | |||
| RF % | |||
| MgSO<sub>4</sub> | |||
| Ca(NO<sub>3</sub>)<sub>2</sub> | |||
| KNO<sub>3</sub> | |||
|- | |||
| Na<sub>2</sub>SO<sub>4</sub> • 10H<sub>2</sub>O | |||
| 87(21°C) | |||
| 74 (21°C) | |||
| 81(21°C) | |||
|} | |||
''Tabelle 1 - Angaben der Gleichgewichtsfeuchten über gesättigten Mischlösungen (Mischungsverhältnis: Gesättigte Lsg.A/ gesättigte Lsg.B =1:1) [nach Vogt/Goretzki 1993].'' | |||
'''Feuchtesorption: ''' | |||
Als weitere Angabe zur Abschätzung der Hygroskopizität von Natriumsulfaten sind in der nachstehenden Tabelle Werte für das Sorptionsverhalten des Reinsalzes und des Gemisches mit Halit bei unterschiedlichen relativen Feuchten wiedergegeben: | |||
Feuchtsorption in M.% nach 56 Tagen Lagerung bei: | |||
== | {| width="200" cellspacing="1" cellpadding="1" border="1" | ||
| Lagerungsfeuchte | |||
| 87% r.F. | |||
| 81% r.F. | |||
| 79% r.F. | |||
|- | |||
| Na2SO4 <br> | |||
| 79 <br> | |||
| 0 <br> | |||
| 0 | |||
|- | |||
| Na2SO4+NaCl (1:1 molare Mischung) | |||
| 157 | |||
| 32 | |||
| 15 | |||
|} | |||
''Tabelle 2 - Sorptionsverhalten von Natriumsulfat [nach Vogt/Goretzki 1993].'' | |||
== Kristallisationsdruck == | == Kristallisationsdruck == | ||
| Zeile 138: | Zeile 174: | ||
Wie erläutert hängt der substanzgefährdende Charakter von Gips v.a. mit der Umwandlungsreaktion Calcit-Gips zusammen. Aus Calcit gebildete Gipsmoleküle besitzen ein Volumen, welches das der ursprünglichen Calcitmoleküle um etwa 100% übersteigt. In diesem Zusammenhang ist als relevanter Schadensfaktor die Veränderung der Wasserlöslichkeit zu nennen. Calcit ist mit einer Wasserlöslichkeit von ca. 0,014g/l (20°C) schwerer löslich als Gips, so daß nach Umwandlung zu Gips ein deutlich wasserempfindlicheres System vorliegt. <br> Hingewiesen sei auf die Untersuchungen von Snethlage und Wendler [1998], die den Einfluß von Gips auf die hygrischen Längenänderungen eines bestimmten Sandsteinmaterials analysiert haben und die beobachtete Schadensbildung in erster Linie auf das veränderte Quellverhalten durch den Gipseinfluß erklären. | Wie erläutert hängt der substanzgefährdende Charakter von Gips v.a. mit der Umwandlungsreaktion Calcit-Gips zusammen. Aus Calcit gebildete Gipsmoleküle besitzen ein Volumen, welches das der ursprünglichen Calcitmoleküle um etwa 100% übersteigt. In diesem Zusammenhang ist als relevanter Schadensfaktor die Veränderung der Wasserlöslichkeit zu nennen. Calcit ist mit einer Wasserlöslichkeit von ca. 0,014g/l (20°C) schwerer löslich als Gips, so daß nach Umwandlung zu Gips ein deutlich wasserempfindlicheres System vorliegt. <br> Hingewiesen sei auf die Untersuchungen von Snethlage und Wendler [1998], die den Einfluß von Gips auf die hygrischen Längenänderungen eines bestimmten Sandsteinmaterials analysiert haben und die beobachtete Schadensbildung in erster Linie auf das veränderte Quellverhalten durch den Gipseinfluß erklären. | ||
<br> | <br> | ||
= Analytischer Nachweis = | = Analytischer Nachweis = | ||
Version vom 19. September 2009, 12:00 Uhr
| Thenardit | |
| [[Image:{{{bild}}}|300px]] | |
| Mineralogische Salzbezeichnung | Thenardit |
| Chemische Bezeichnung | Natriumsulfat |
| Trivialname | Makit, Menardit, Pyrotechnit |
| Chemische Formel | Na2SO4 |
| Hydratformen |
Mirabilit (Na2SO4 • 10H2O), Natriumsulfatheptahydrat (Na2SO4 • 7H2O) |
| Kristallklasse | orthorhombisch |
| Deliqueszenzfeuchte 20°C | - |
| Dichte (g/cm³) | 2,7 |
| Molvolumen | 53,11cm3/mol |
| Molgewicht | 142,04g/mol |
| Transparenz | |
| Spaltbarkeit | |
| Kristallhabitus | |
| Zwillingsbildung | |
| Brechungsindices | nx = 1,468; ny = 1,473; nz = 1,483 |
| Doppelbrechung | Δ = 0,015 |
| Optische Orientierung | |
| Pleochroismus | |
| Dispersion | |
| Phasenübergang | - |
| Chemisches Verhalten | |
| Bemerkungen | in wasserfreiem Ethanol unlöslich, löslich in Glycerin |
Autoren: Hans-Jürgen Schwarz , Nils Mainusch, NN....
Abstract[Bearbeiten]
Einleitung[Bearbeiten]
Allgemeines[Bearbeiten]
Vorkommen von Thenardit
[Bearbeiten]
Sowohl Thenardit wie auch Mirabilit erscheinen als natürliche Mineralien. In Mineralwässern, als Ablagerungen ehemaliger Salzseen und in Form unterschiedlicher Doppelsalze tritt Natriumsulfat in der Natur auf. Die Kenntnis des kristallwasserhaltigen Natriumsulfates reicht nachweislich bis in das 16. Jh. zurück. Erste Beschreibungen desselben sind von Glauber aus dem Jahre 1658 überliefert, welcher es als “sal mirable” bezeichnete. Auf dessen Namen zurückgehend ist auch
die Trivialbezeichnung “Glaubersalz” für Mirabilit in der Literatur anzutreffen.
Angaben zu Herkunft und Bildung von Thenardit an Baudenkmalen
[Bearbeiten]
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumsulfat als Ausblühsalz entstehen, wenn mit schwefeligen Gasen kontaminierte Luft einwirkt oder sonstige Sulfatquellen vorliegen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch können 100 kg Portlandzement mit einem Gehalt von lediglich 0,1% löslichem Na2O in schwefelsäurehaltiger Luft 520g Mirabilit ausbilden [Angaben nach Arnold/Zehnder 1991]. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendeten Restaurierungsprodukten (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächenwasser anzuführen, die Na+-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem Natriumchlorid. In Küstennähe ist NaCl-haltiges Meerwasser als Natriumquelle zu berücksichtigen.
Angaben zum Schadenspotential und zur Verwitterungsaktivität von Thenardit[Bearbeiten]
Lösungsverhalten[Bearbeiten]
Die an Bauwerken auftretenden Natriumsulfate Thenardit und Mirabilit zählen zur Gruppe der leichtlöslichen und somit leicht mobilisierbaren Salzen (vgl.Tabelle Hygroskopizität der Salze und Gleichgewichtsfeuchte). Die temperaturabhängige Veränderung der Löslichkeit der Natriumsulfate ist groß. Mit dem starken Einfluß der Temperatur auf die Löslichkeit von Thenardit ist die Gefahr einer Lösungsübersättigung bei raschem Temperaturabfall und Kristallisation des Salzes verbunden.
Diagramm 1 - Darstellung der temperaturabhängigen Veränderung der Löslichkeit von Thenardit und Mirabilit im
Vergleich mit anderen Salzphasen [nach Stark/Stürmer 1993].
Hygroskopizität[Bearbeiten]
Im unteren ist der Temperatureinfluß auf die Deliqueszenzpunkte von Thenardit und Mirabilit verdeutlicht. Auffällig sind hierbei die gegenläufigen Kurvengänge.
Diagramm 2 - Deliqueszenzpunkte der Reinsalze Thenardit und Mirabilit [nach Arnold/Zehnder 1991].
In Anwesenheit von Fremdionen (bei Salzgemischen) verändern sich die Parameter der Gleichgewichtsfeuchte und der notwendigen Temperatur- und Feuchtebedingungen für Umkristallisationen zudem deutlich. Als orientierende Daten sind in der unteren Tabelle experimentell erfaßte Werte der Gleichgewichtsfeuchte in unterschiedlichen Salzgemischen wiedergegeben. Es zeigt sich, daß alle Werte der Gleichgewichtsfeuchte unter denen des Reinsalzes Mirabilit liegen.
| RF % | MgSO4 | Ca(NO3)2 | KNO3 |
| Na2SO4 • 10H2O | 87(21°C) | 74 (21°C) | 81(21°C) |
Tabelle 1 - Angaben der Gleichgewichtsfeuchten über gesättigten Mischlösungen (Mischungsverhältnis: Gesättigte Lsg.A/ gesättigte Lsg.B =1:1) [nach Vogt/Goretzki 1993].
Feuchtesorption:
Als weitere Angabe zur Abschätzung der Hygroskopizität von Natriumsulfaten sind in der nachstehenden Tabelle Werte für das Sorptionsverhalten des Reinsalzes und des Gemisches mit Halit bei unterschiedlichen relativen Feuchten wiedergegeben:
Feuchtsorption in M.% nach 56 Tagen Lagerung bei:
| Lagerungsfeuchte | 87% r.F. | 81% r.F. | 79% r.F. |
| Na2SO4 |
79 |
0 |
0 |
| Na2SO4+NaCl (1:1 molare Mischung) | 157 | 32 | 15 |
Tabelle 2 - Sorptionsverhalten von Natriumsulfat [nach Vogt/Goretzki 1993].
Kristallisationsdruck[Bearbeiten]
Bei der Kristallisation aus wäßriger Lösung, die eine Übersättigung im Verhältnis 2:1 aufweist, läßt sich für Gips ein linearer Wachstumsdruck von 28,2-33,4 N/mm2 im Temperaturbereich 0-50°C angeben. Im Vergleich mit anderen bauschädlichen Salzen liegen diese Werte im mittleren Bereich einer berechneten Werteskala, die insgesamt von 7,2 bis 65,4 N/mm2 reicht [nach Winkler, 1975].
Hydratationsverhalten[Bearbeiten]
Das System CaSO4 – H2O:
Calciumsulfat kann in drei unterschiedlichen Hydratstufen auftreten, dem oben bezeichneten, kristallwasserlosen Anhydrit, einem Halbhydrat, welches unter Normalbedingungen die instabilste Form darstellt, und Gips. Anhydrit existiert in verschiedenen Modifikationen, wodurch je nach Abhängigkeit der Modifikation des vorliegenden Anhydrit unterschiedliche chemische Eigenschaften (z.B. variierende Löslichkeit in Wasser) feststellbar sind. Das gleiche gilt auch für die Modifikationen des Halbhydrates.
Als Wert für die Übergangstemperatur (in wäßriger Lösung) kann der Bereich 40°C-66°C angegeben werden. Unter normalen Klimabedingungen an Denkmalen entsteht somit beim Ausfall von Calciumsulfat aus einer wäßrigen Lösung in erster Linie Gips. Liegen die Temperatur einer Lösung höher als 40°C-60°C, bildet sich v.a. Anhydrit. Parallel hierzu kommt es zur Bildung des Halbhydrates, welches zwar metastabil ist, beim Ausfall aber zunächst in großer Menge auftritt und dann in eine der stabileren Hydratstufen umgebildet wird.
Bei der Erhitzung des Doppelhydrates (als Feststoff in Abwesenheit von wäßrigem Lösungsmittel) kommt es bei einer Temperatur ab etwa 50°C zum Austreiben von Kristallwasser, und es entsteht das Halbhydrat. Die vollständige Überführung zum Halbhydrat findet erst bei Temperaturen von ca. 100°C statt. Wird das Doppelhydrat längere Zeit auf 500-600°C erhitzt, liegt völlig entwässertes Calciumsulfat vor. Bei Temperaturen über 1000°C erfolgt die Zersetzung in Calciumoxid und SO3.
Hydratationsdruck[Bearbeiten]
An einem Objekt vorliegender Gips kann das im Molekül enthaltene Kristallwasser nur bei Temperaturen ab ca. 50°C abgeben, wird also in der Regel nicht dehydrieren. Umgekehrt ist die Einlagerung von Kristallwasser bei Vorliegen von Anhydrit oder Halbhydrat an einem Denkmal aber durchaus möglich. Beide Vorgänge sind mit Volumenveränderungen (von 31,9% beim Übergang Halbhydrat-Gips) und dem Entstehen von Hydratationsdrücken verbunden [Zahlenwerte nach Sperling/Cooke, 1980]. Für den Fall des Überganges Halbhydrat-Gips (Stichwort Gipstreiben) kann bei einer Temperatur im Bereich 0-20°C und einer r.F. von ca. 80% ein Hydratationsdruck von 114 –160 N/mm2 angegeben werden, was extrem hohe Werte darstellt [nach Stark/Stürmer 1996]<bibref>Stark.etal:1996</bibref>.
Umwandlungsreaktionen[Bearbeiten]
Wie erläutert hängt der substanzgefährdende Charakter von Gips v.a. mit der Umwandlungsreaktion Calcit-Gips zusammen. Aus Calcit gebildete Gipsmoleküle besitzen ein Volumen, welches das der ursprünglichen Calcitmoleküle um etwa 100% übersteigt. In diesem Zusammenhang ist als relevanter Schadensfaktor die Veränderung der Wasserlöslichkeit zu nennen. Calcit ist mit einer Wasserlöslichkeit von ca. 0,014g/l (20°C) schwerer löslich als Gips, so daß nach Umwandlung zu Gips ein deutlich wasserempfindlicheres System vorliegt.
Hingewiesen sei auf die Untersuchungen von Snethlage und Wendler [1998], die den Einfluß von Gips auf die hygrischen Längenänderungen eines bestimmten Sandsteinmaterials analysiert haben und die beobachtete Schadensbildung in erster Linie auf das veränderte Quellverhalten durch den Gipseinfluß erklären.
Analytischer Nachweis[Bearbeiten]
Mikroskopie
[Bearbeiten]
Laboruntersuchung:
Gips ist gering wasserlöslich, so daß gipshaltiges Probematerial beim Versetzen mit Aquadest. nur geringfügig in Lösung geht. Wird gipshaltiges Probematerial in Lösung gebracht, entstehen bei vorsichtigem Einengen des Lösungmitteltropfens im Zuge der Rekristallisation zunächst Einzelnadeln und zunehmend nadelige Gipsaggregate im Bereich des Saumes der Lösung. (alternativ kann Probematerial mit Salzsäure versetzt werden, was ebenfalls zur Bildung von Kristallnadeln führt). Im Vergleich zu anderen Salzen, die ebenfalls nadelig rekristallisieren können wie z.B. Natriumcarbonat, weisen Gipsnadeln eine deutlich geringere Länge auf.
Brechungsindizes: nx = 1.521; ny =1.523; nz =1.530
Doppelbrechung: Δ = 0.009
Kristallklasse: monoklin
Polarisationsmikroskopische Untersuchung:
Außer dem typischen, nadeligen Habitus von Gipskristallen (v.a. von rekristallisiertem Material) treten unterschiedliche morphologische Charakteristika auf, die bei der Identifikation von Gips hilfreich sind. Gipspartikel (in Rohprobematerial) zeigen sich häufig in Form von gerundeten Splittern und tafeligen Rhomboedern, an denen deutliche, innere Spaltflächen ablesbar sind. Darüber hinaus ist das Auftreten von Zwillingsformen sowohl bei lattigen Partikeln wie auch Tafeln und Plättchen typisch für Gips.
Die Zuweisung der Brechungsindizes erfolgen entsprechend der Immersionsmethode unter Verwendung von Medien mit den Indizes nD=1,518 und nD=1,53, wobei aufgrund der zumeist sehr kleinteiligen Partikel die Überprüfung des Schroeder van der Kolk- Schatten aussagekräftiger und sicherer ist, als der Becke-Linien Test.
Gipskristalle gehören zur Klasse der monoklinen Kristalle zeigen also je nach Ausrichtung des Einzelpartikels unter dem Mikroskop zum einen sowohl parallele, bzw. symmetrische Auslöschung, weisen v.a. jedoch eine charakteristische schiefe Achsenstellung in der Auslöschungsposition auf. An gut ausgebildeten Kristallrhomben ist diese schiefe Auslöschung zumeist klar meßbar.
Von allen Calciumsulfaten ist Gips am geringsten doppelbrechend und erscheint bei gekreuzten Polarisatoren mit sehr niedrigen Interferenzfarben, die (natürlich in Abhängigkeit der vorliegenden Partikeldicke) im Bereich grau bis gelblich weiß der ersten Ordnung liegen.
Verwechslungsmöglichkeiten:
Gips ist im dargestellten Analyseverfahren eindeutig zuweisbar, sofern die folgenden Untersuchungskriterien eindeutig geklärt sind:
- geringe Wasserlöslichkeit
- charakteristisch nadelige Morphologie bei rekristallisierten Partikeln
- alle beobachtbaren Indizes besitzen einen nD –Wert zwischen 1,518 und 1,530
- Gipskristalle besitzen eine geringe Doppelbrechung und niedrige Interferenzfarben
- Gipskristalle weisen eine schiefe Auslöschung auf
Salzphasen, die gipsähnliche chemische und optische Eigenschaften aufweisen, sind nachstehend
aufgelistet:
| Salzphase | Unterscheidungsmerkmale zu Gips |
| Syngenit; K2Ca(SO4)•2H2O | alle beobachtbaren Indizes < 1,518 |
| Tachyhydrit; CaMg2Cl6•12H2O | zumeist ein beobachtbarer Index < 1,518 / nur parallele und symmetrische Auslöschung |
| Hydromagnesit; Mg5[OH(CO3)2]2•4H2O | ein Index zumeist > 1,53 |
Röntgendiffraktometrie[Bearbeiten]
Raman-Stektroskopie[Bearbeiten]
DTA/TG[Bearbeiten]
IR-Spektroskopie[Bearbeiten]
Umgang mit Gipsschäden[Bearbeiten]
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
- Auf dem Objektträger rekristallisiert
- Gips-1.jpg
Gipskristalle unter polarisiertem Licht
- Gips-2.jpg
Gipskristalle unter polarisiertem Licht, Rot I
- Im Dünnschliff von Objektproben
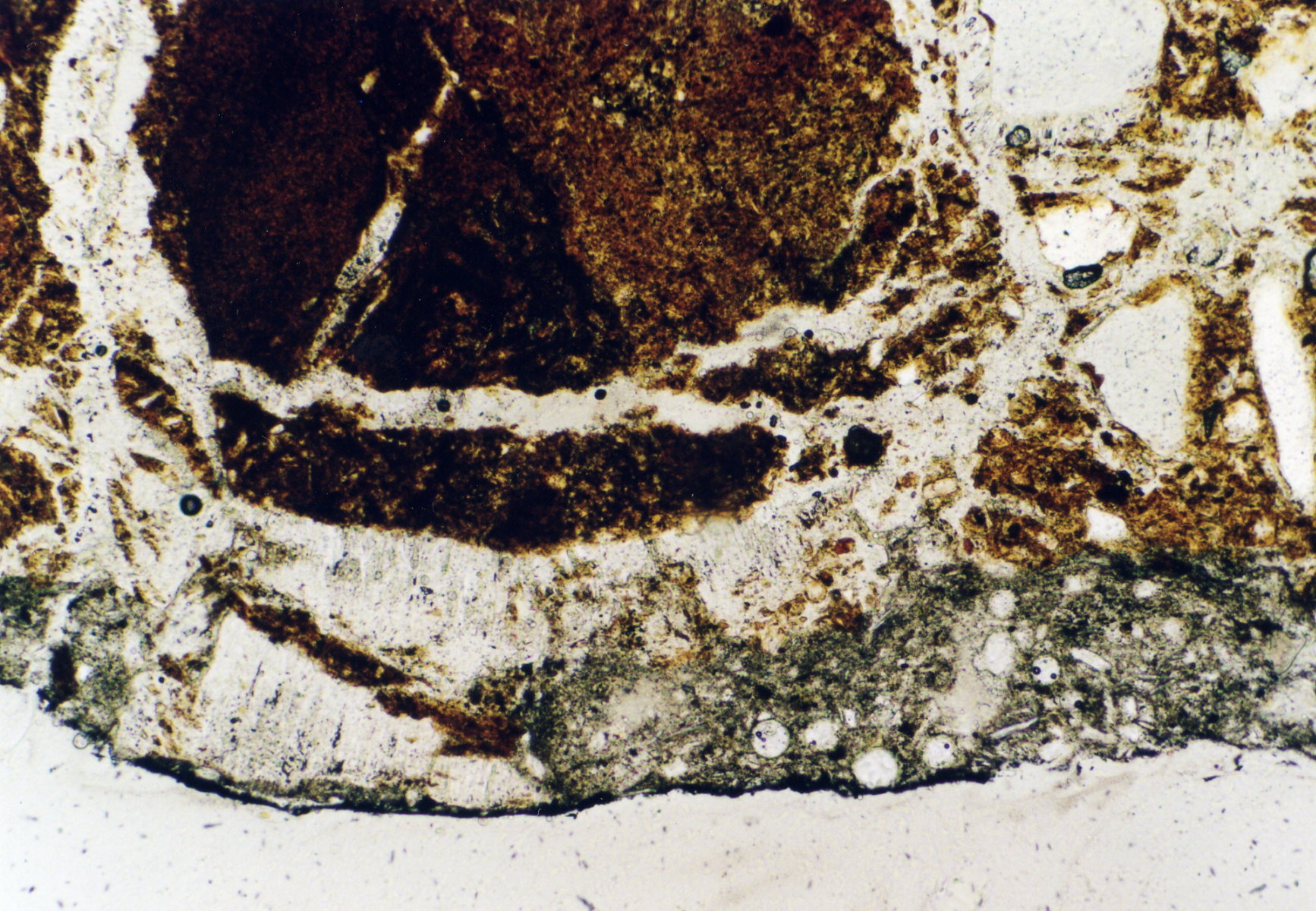
- Per 270603 5-13 16.jpg
Gipsgeschädigter Ziegel, St. Jakobi Perleberg
Unter dem Rasterelektronenmikroskop[Bearbeiten]
- Im Rasterelektronenmikoskop
- CaSO4-REM-SG2-1.jpeg
Gipskristalle im REM
- CaSO4-REM-SG2-2.jpeg
Gipskristalle im REM
- CaSO4-REM-SG2-3.jpeg
Gipskristalle im REM
- CaSO4-REM-SG2-SPC.jpeg
Gipskristalle im REM
- CaSO4-REM-SG3-1.jpeg
Gipskristalle im REM
- CaSO4-REM-SG3-2.jpeg
Gipskristalle im REM
- CaSO4-REM-SG3-3.jpeg
Gipskristalle im REM
- CaSO4-REM-SG3-SPC2.jpeg
Gipskristalle im REM
Weblinks
[Bearbeiten]
http://webmineral.com/data/Gypsum.shtml
http://www.mindat.org/min-1784.html
http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Gips
Literatur[Bearbeiten]
<bibreferences/>