Mikroskopie der Salze: Unterschied zwischen den Versionen
| Zeile 180: | Zeile 180: | ||
</dpl> | </dpl> | ||
<gallery caption="Natriumcarbonat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Natriumcarbonat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image:HJS_Na2CO3_092903-5.jpg|Abbildung 32:Natriumcarbonatkristalle unter polarisiertem Licht | Image:HJS_Na2CO3_092903-5.jpg|Abbildung 32: Natriumcarbonatkristalle unter polarisiertem Licht | ||
Image:HJS_Na2CO3_092903-4.jpg|Abbildung 33:Natriumcarbonatkristalle unter polarisiertem Licht Ausschnitt von vorherigem Foto | Image:HJS_Na2CO3_092903-4.jpg|Abbildung 33: Natriumcarbonatkristalle unter polarisiertem Licht Ausschnitt von vorherigem Foto | ||
Image:HJS_Na2CO3_092903-3.jpg|Abbildung 34:Natriumcarbonatkristalle unter polarisiertem Licht mit Analysator und Rot I | Image:HJS_Na2CO3_092903-3.jpg|Abbildung 34: Natriumcarbonatkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
</gallery> | </gallery> | ||
Version vom 11. Juni 2011, 14:14 Uhr
<bibimport />
Autor: Hans-Jürgen Schwarz
zurück zu Verfahren zur Salzanalyse
Abstract[Bearbeiten]
Die Bestimmung von Salzen mit einem Polarisationsmikroskop wird beschrieben.
Vorgehensweise[Bearbeiten]
Die Untersuchung von Salzen kann auf unterchiedliche Art erfolgen. Wichtig ist jedoch, dass immer sowohl die Anionen und Kationen bestimmt werden, wenn möglich auch die Phasen, das heist die Salze selbst. Bei der üblichen chemischen Analyse wird in der Regel das Carbonat-Ion nicht bestimmt, so dass auch die entsprechenden Salze dann oft nicht gefunden werden, obwohl sie in vielen Fällen die Hauptsalze sein können.
Zwei unterschiedliche Herangehensweisen zur mikroskopischen Salzanalyse werden hier vorgestellt.
Die eine Art der Untersuchung von Salzen bezieht sich auf die Analyse des Salzes an sich, so wie es vom Objekt als Salzktristall genommen wurde. Die andere Möglichkeit analysiert die aus einer wässrigen Lösung auskristallsierenden Salze, sei es, indem man die Salzkristalle in Lösung bringt, oder indem man einen wässrigen Auszug eines Baustoffes erstellt. Beides führt zu Salzkristallisationen, die im Folgenden beschrieben werden und sich je nach Salztyp mehr oder weniger unterscheiden können. Siehe hierzu auch das Kapitel Mikrochemie.
Bestimmung von Einzelsalzen aus dem wässrigen Auszug[Bearbeiten]
Vor der eigentlichen Salzbestimmung wird die zu untersuchende Probe, ob Reinsalz oder Materialprobe, mit wenigen Tropfen destilliertem Wasser versetzt und ein wässriger Auszug nach Bläuer erstellt. Von diesem werden mehrere Tropfen auf einen Objektträger gebracht und unter dem Polarisationsmikroskop beobachtet. Wichtig ist, dass man die Auskristallisation der Salze aus der Lösung von Anfang an, also mit den ersten kleinen Kristallen, bis zum Ende der Krisatllisation beobachtet. Nur dann können die richtigen Schlüsse gezogen werden, da z.B zu Beginn auskristallisierende Salze durch nachfolgende komplett überdeckt und somit am Ende der Kristallisation kaum noch erkannt und bestimmt werden können. Von großer Bedeutung ist deshalb auch die Möglichkeit der kontinulierlichen Dokumentaion dessen, was man beobachtet.
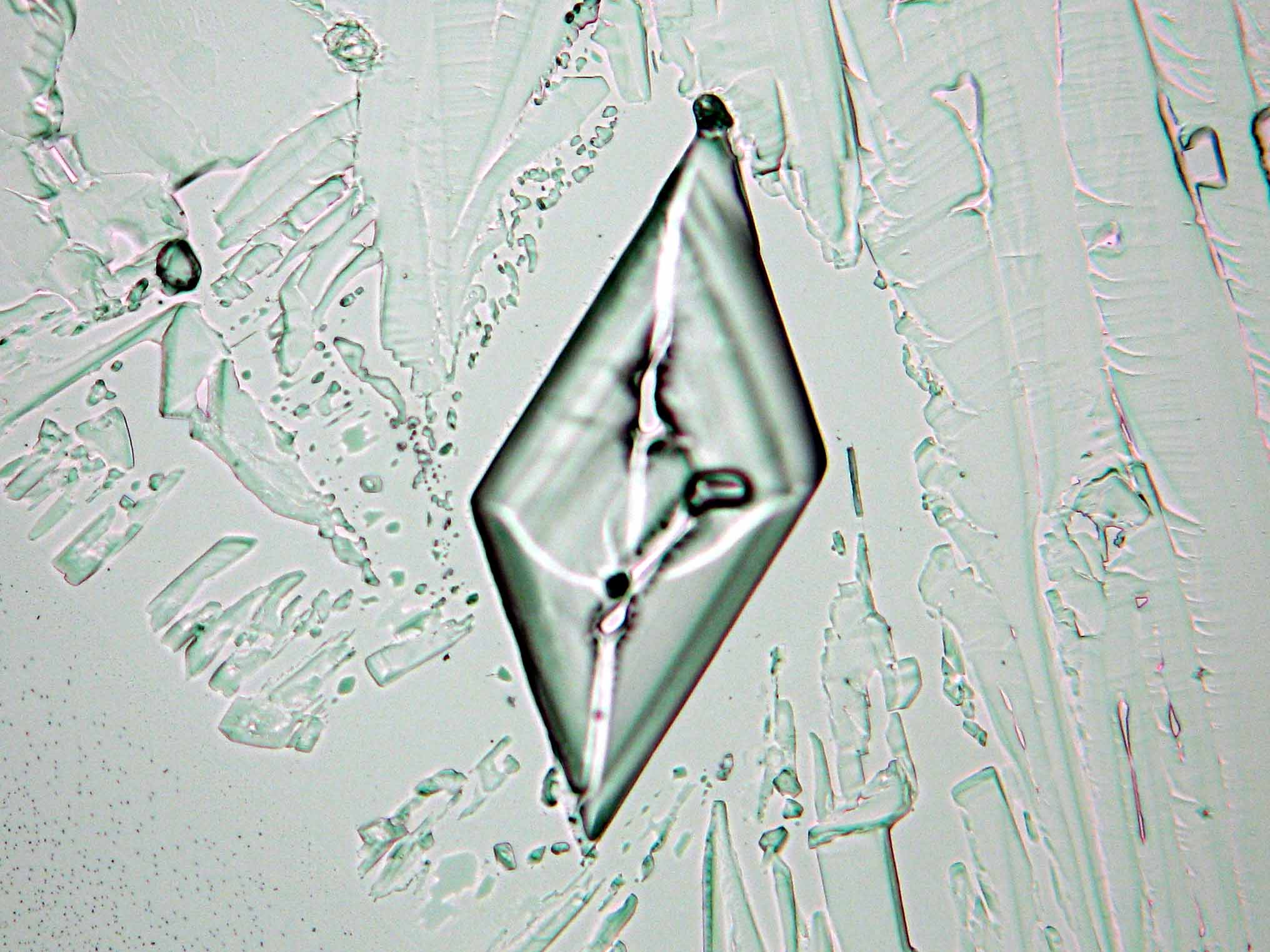
Halit[Bearbeiten]
In den Abbildungen 1-3 sind Halitkristalle zu erkennen, die neben KCl die einzigen isotropen und damit dem kubischen Kristallsystem angehörenden Salze sind. Im Umkehrschluss gilt nicht, dass alle auf einem Objekträger isotrop erscheinen Kristalle auch kubisch sind wie Halit und Sylvin, da manche Salze (vgl. Abb. ??), auf dem Objektträger derart orientiert auskrisallisieren, dass sie optisch isotrop erscheinen. Hier ist also Vorsicht geboten. Zusammen mit den typisch kubischen Kristallformen ist die Beobachtung jedoch eindeutig.
| Salz | chemFormel | Doppelbrechung | Brechungsindices | Kristallklasse | optOrientierung |
|---|---|---|---|---|---|
| Test | NaCl | nD=1,544 | isotrop | ||
| Halit | NaCl | nD=1,5443 | isotrop |
- Halit aus wässriger Lösung auf einem Objektträger kristallisiert
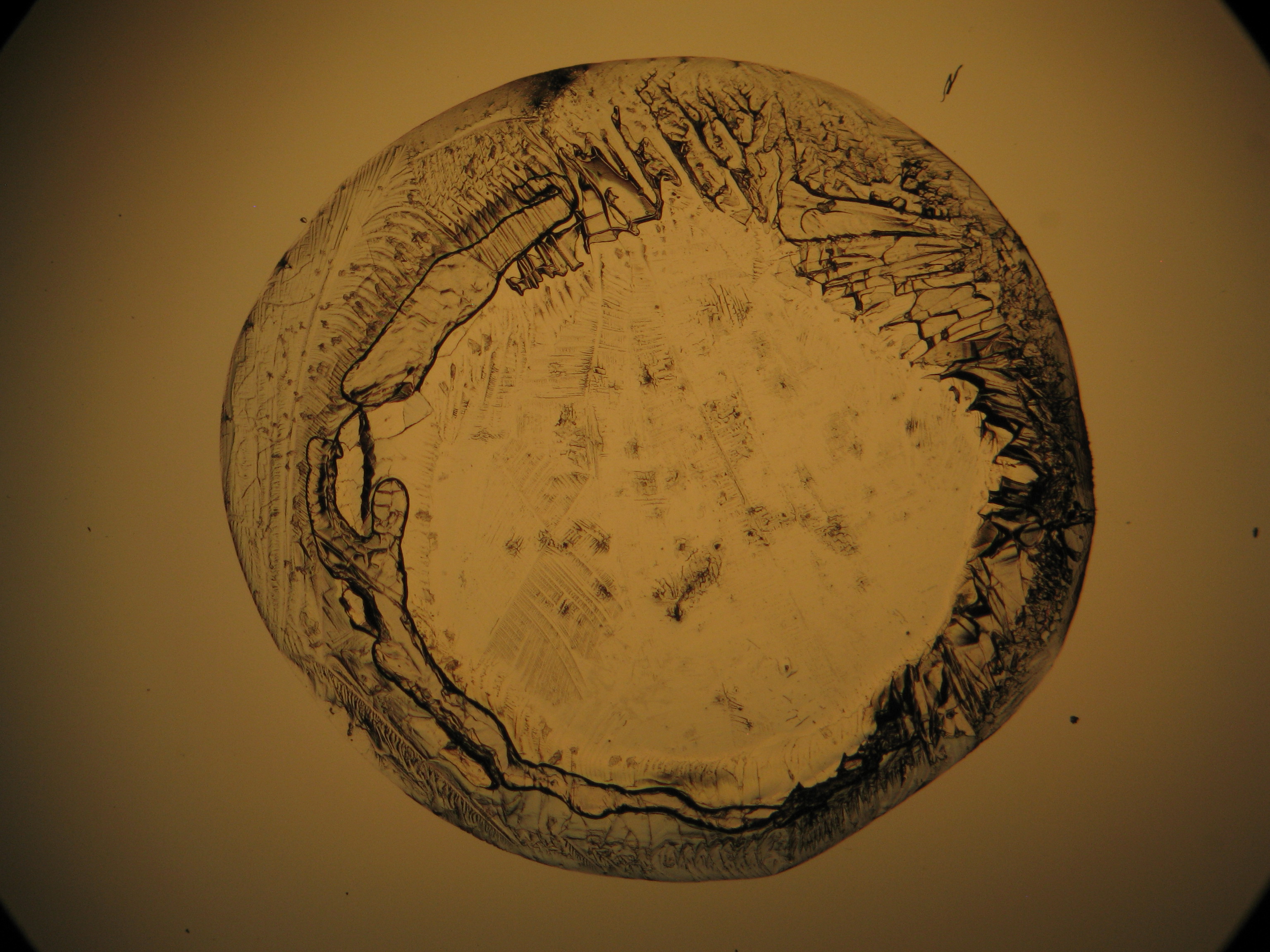
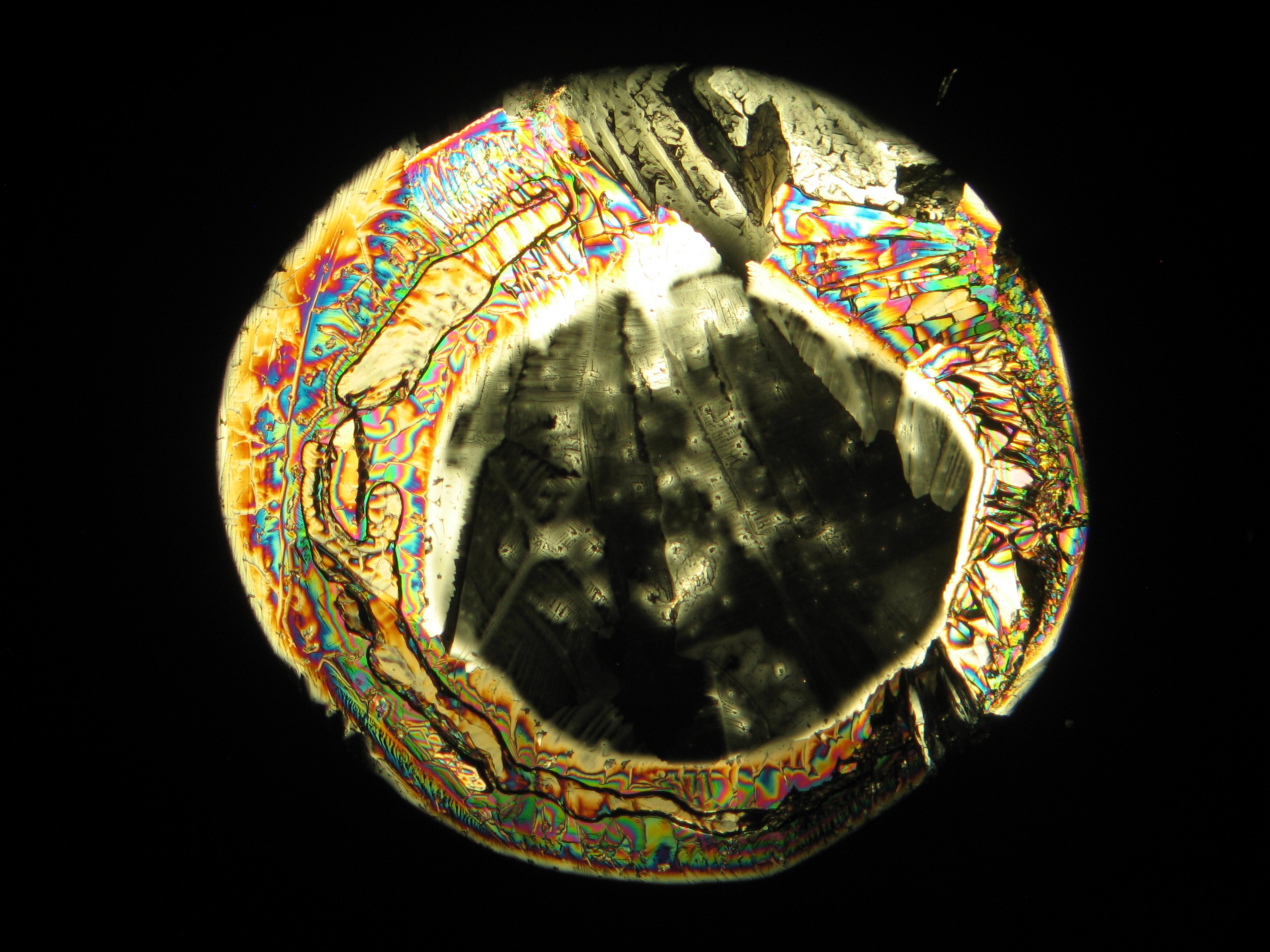
Calciumchlorid[Bearbeiten]
Calciumchlorid kristallisiert nur bei relativ niedriger relativer Luftfeuchte (bei Reinsalzen bei RH < 30,8% bei 20°C) aus. Da die relative Luftfeuchte an den Objekten und auch im Laborraum meist über diesem Wert liegt, ist Calciumchlorid nur selten kristallin am Objekt zu beobachten. Um die Kristalle unter der Polarisationsmikroskop zu beobachten, besteht die Möglichkeit, den Objektträger soweit zu erwärmen, bis sich Kristalle bilden. Diese lösen sich jedoch beim Abkühlen rasch wieder in der Luftfeuchte. In den Abbildungen 4-6 sind Calciumchloridkristalle nach dem Erwärmen abgebildet.
| Salz | chemFormel | Doppelbrechung | Brechungsindices | Kristallklasse | optOrientierung |
|---|---|---|---|---|---|
| Antarcticit | CaCl2•6H2O | Δ= 0,055 | no =1,417-1,495 ne = 1,393-1,550 |
einachsig negativ |
- Calciumchlorid aus wässriger Lösung auf einem Objektträger kristallisiert
Niter[Bearbeiten]
| Salz | chemFormel | Doppelbrechung | Brechungsindices | Kristallklasse | optOrientierung |
|---|---|---|---|---|---|
| Niter | KNO3 | Δ = 0,171 | nx = 1,335 ny = 1,505 nz = 1,506 |
zweiachsig negativ |
- Niter aus wässriger Lösung auf einem Objektträger kristallisiert
Calciumnitrat[Bearbeiten]
| Salz | chemFormel | Doppelbrechung | Brechungsindices | Kristallklasse | optOrientierung |
|---|---|---|---|---|---|
| Nitrocalcit | Ca(NO3)2•4H2O | Δ = 0,039 | nx = 1,465 ny = 1,498 nz = 1,504 |
negativ |
- Calciumnitrat aus wässriger Lösung auf einem Objektträger kristallisiert
Magnesiumnitrat[Bearbeiten]
| Salz | chemFormel | Doppelbrechung | Brechungsindices | Kristallklasse | optOrientierung |
|---|---|---|---|---|---|
| Nitromagnesit | Mg(NO3)2•6H2O | Δ = 0,166 | nx = 1,34 ny = 1,506 nz = 1,506 |
negativ |
- Magnesiumnitrat aus wässriger Lösung auf einem Objektträger kristallisiert
Gips[Bearbeiten]
| Salz | chemFormel | Doppelbrechung | Brechungsindices | Kristallklasse | optOrientierung |
|---|---|---|---|---|---|
| Gips | CaSO4•2 H2O | Δ = 0,0092 | nx = 1,5207 ny = 1,5230 nz = 1,5299 |
zweiachsig positiv |
- Gips aus wässriger Lösung auf einem Objektträger kristallisiert
Magnesiumsulfat[Bearbeiten]
| Salz | chemFormel | Doppelbrechung | Brechungsindices | Kristallklasse | optOrientierung |
|---|---|---|---|---|---|
| Epsomit | MgSO4•7H2O | Δ = 0,0284 | nx = 1,432 ny = 1,453 nz = 1,4609 |
zweiachsig negativ |
- Magnesiumsulfat aus wässriger Lösung auf einem Objektträger kristallisiert
Natriumsulfat[Bearbeiten]
| Salz | chemFormel | Doppelbrechung | Brechungsindices | Kristallklasse | optOrientierung |
|---|---|---|---|---|---|
| Thenardit | Na2SO4 | Δ = 0,013 | nx = 1,471 ny = 1,477 nz = 1,484 |
positiv | |
| Natriumsulfat-Heptahydrat | Na2SO4•7H2O | ||||
| Natriumsulfat | |||||
| Mirabilit | Na2SO4•10H2O | Δ = 0,004 | nx = 1,394 ny = 1,396 nz = 1,398 |
negativ | |
| Natriumsulfat Phase III | Na2SO4 |
- Natriumsulfat aus wässriger Lösung auf einem Objektträger kristallisiert
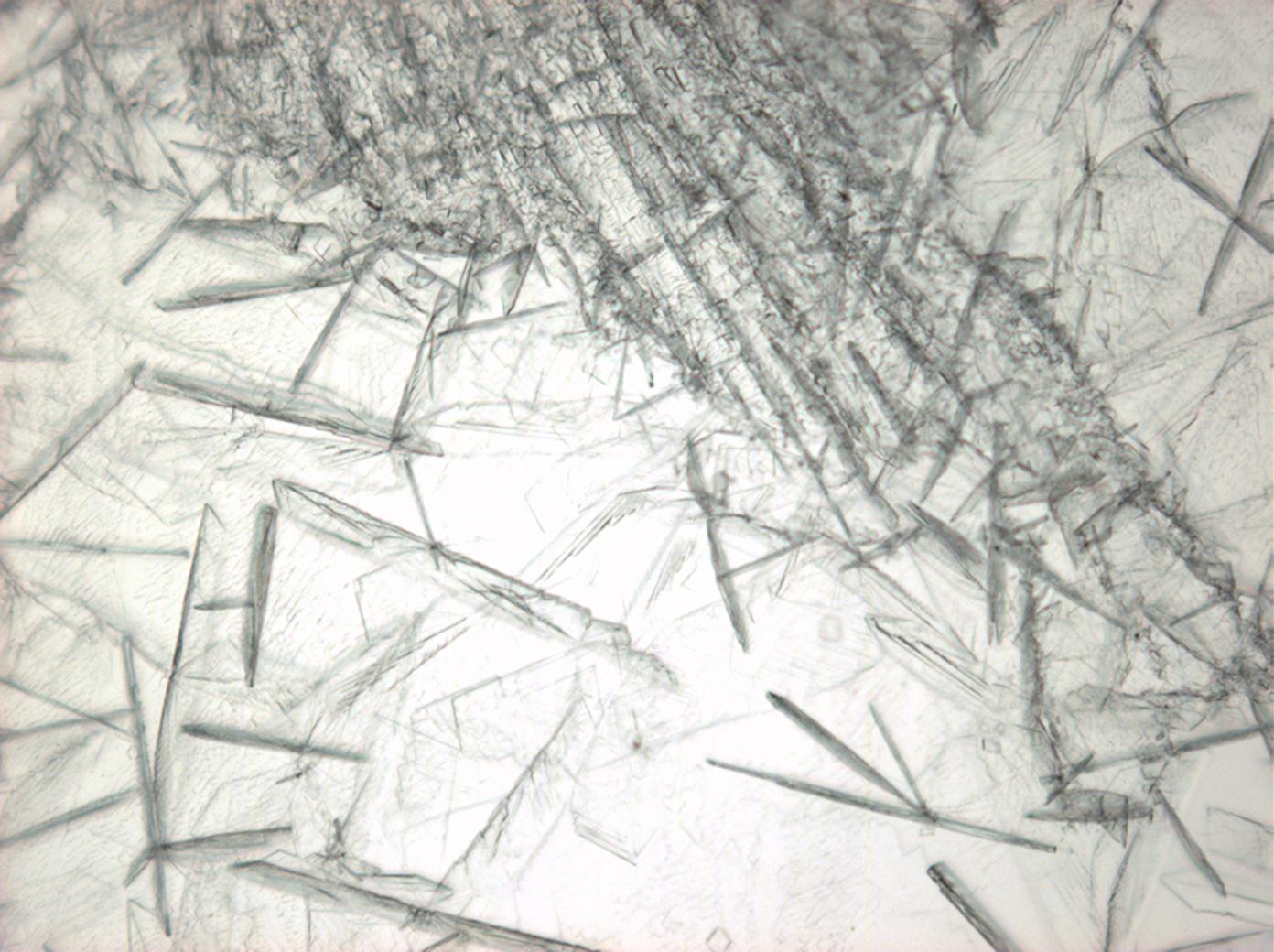
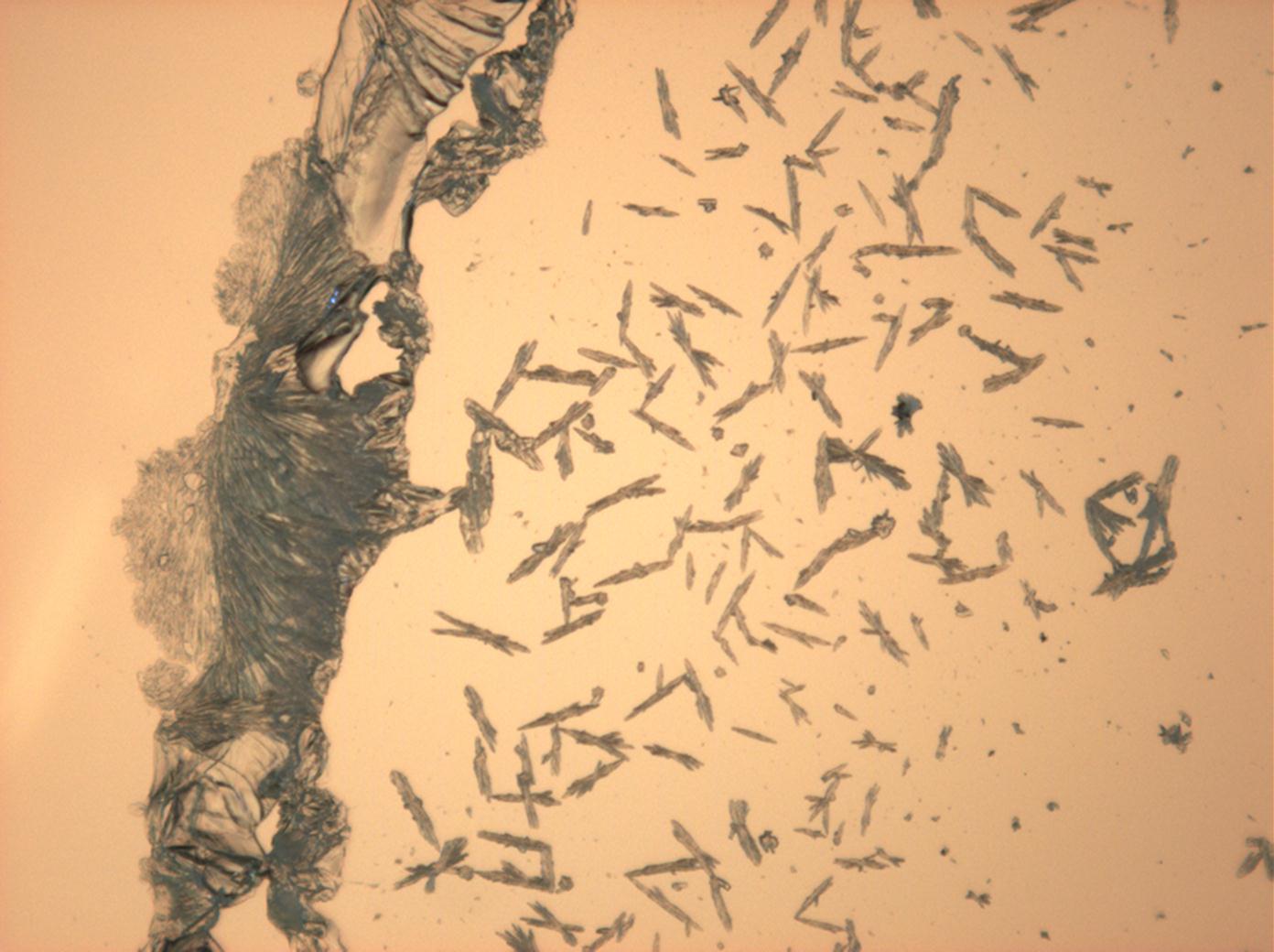
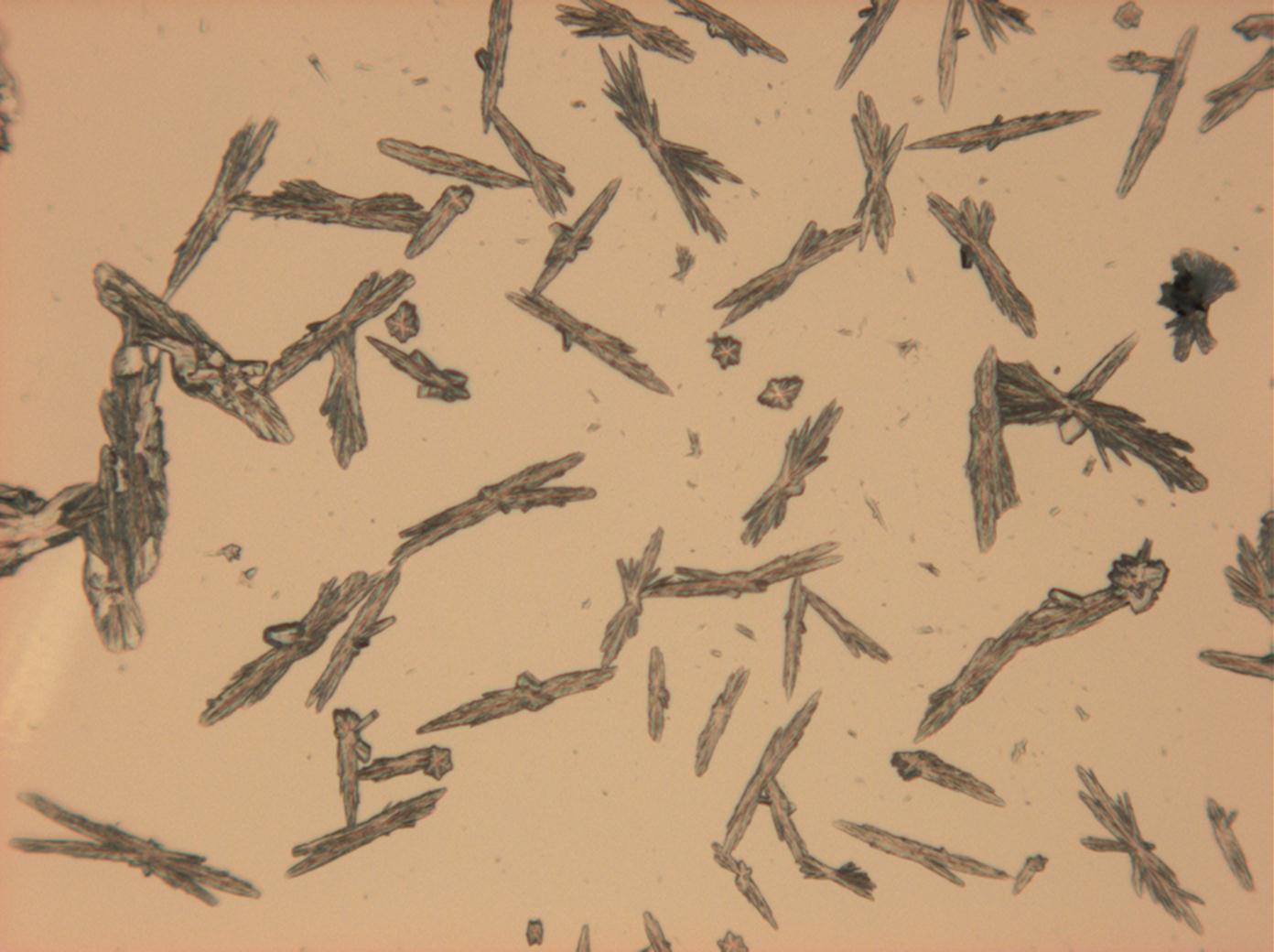
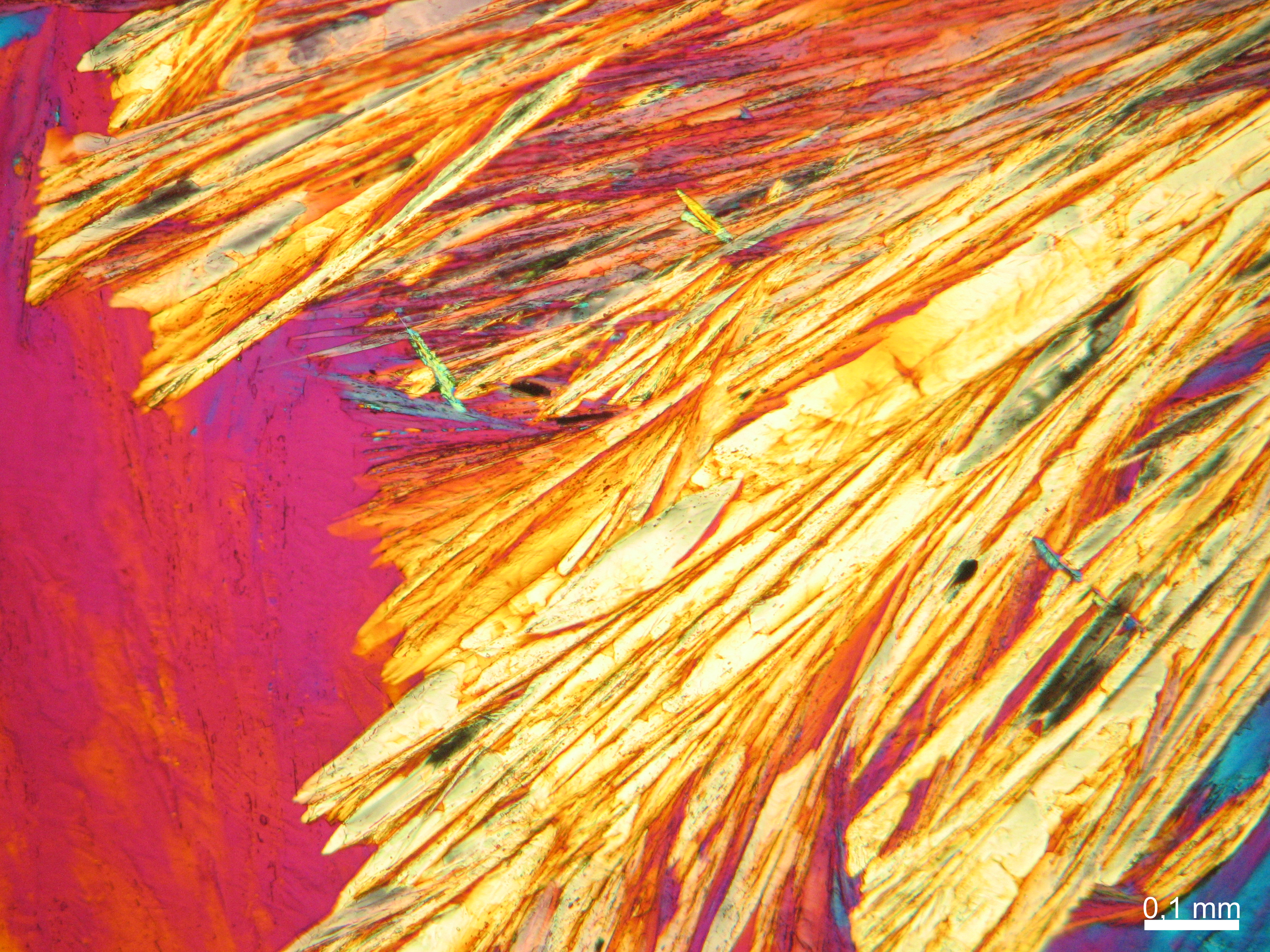
Natriumcarbonat[Bearbeiten]
| Salz | chemFormel | Doppelbrechung | Brechungsindices | Kristallklasse | optOrientierung |
|---|---|---|---|---|---|
| Natrit | Na2CO3 | Δ = 0,131 | nx = 1,415 ny = 1,535 nz = 1,546 |
zweiachsig negativ |
- Natriumcarbonat aus wässriger Lösung auf einem Objektträger kristallisiert
Natriumacetat[Bearbeiten]
- Natriumacetat aus wässriger Lösung auf einem Objektträger kristallisiert