Mikroskopie der Salze: Unterschied zwischen den Versionen
Ricon (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
|||
| (45 dazwischenliegende Versionen von 4 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autor: [[Benutzer:Hschwarz|Hans-Jürgen Schwarz]] | Autor: [[Benutzer:Hschwarz|Hans-Jürgen Schwarz]] | ||
| Zeile 6: | Zeile 5: | ||
zurück zu [[Verfahren zur Salzanalyse|Verfahren zur Salzanalyse]] | zurück zu [[Verfahren zur Salzanalyse|Verfahren zur Salzanalyse]] | ||
<br> | <br> | ||
| Zeile 23: | Zeile 19: | ||
Zwei unterschiedliche Herangehensweisen zur mikroskopischen Salzanalyse werden hier vorgestellt. | Zwei unterschiedliche Herangehensweisen zur mikroskopischen Salzanalyse werden hier vorgestellt. | ||
Die eine Art der Untersuchung von Salzen bezieht sich auf die Analyse des Salzes an sich, so wie es vom Objekt als Salzktristall genommen wurde. Die andere Möglichkeit analysiert die aus einer wässrigen Lösung auskristallsierenden Salze, sei es indem man die Salzkristalle in Lösung bringt oder indem man einen wässrigen Auszug eines Baustoffes erstellt. Beides führt zu Salzkristallisationen, die im Folgenden beschrieben werden und sich je nach Salztyp mehr oder weniger unterscheiden können. Siehe hierzu auch das Kapitel [[Mikrochemie]]. | Die eine Art der Untersuchung von Salzen bezieht sich auf die Analyse des Salzes an sich, so wie es vom Objekt als Salzktristall genommen wurde. Die andere Möglichkeit analysiert die aus einer wässrigen Lösung auskristallsierenden Salze, sei es, indem man die Salzkristalle in Lösung bringt, oder indem man einen wässrigen Auszug eines Baustoffes erstellt. Beides führt zu Salzkristallisationen, die im Folgenden beschrieben werden und sich je nach Salztyp mehr oder weniger unterscheiden können. Siehe hierzu auch das Kapitel [[Mikrochemie]]. | ||
== Bestimmung von Einzelsalzen aus dem wässrigen Auszug == | == Bestimmung von Einzelsalzen aus dem wässrigen Auszug == | ||
Vor | Vor der eigentlichen Salzbestimmung wird die zu untersuchende Probe, ob Reinsalz oder Materialprobe, mit wenigen Tropfen destilliertem Wasser versetzt und ein wässriger [[Mikrochemie#Testmethoden|Auszug nach Bläuer]] erstellt. Von diesem werden mehrere Tropfen auf einen Objektträger gebracht und unter dem Polarisationsmikroskop beobachtet. Wichtig ist, dass man die Auskristallisation der Salze aus der Lösung von Anfang an, also mit den ersten kleinen Kristallen, bis zum Ende der Krisatllisation beobachtet. Nur dann können die richtigen Schlüsse gezogen werden, da z.B zu Beginn auskristallisierende Salze durch nachfolgende komplett überdeckt und somit am Ende der Kristallisation kaum noch erkannt und bestimmt werden können. Von großer Bedeutung ist deshalb auch die Möglichkeit der kontinulierlichen Dokumentaion dessen, was man beobachtet. | ||
== Halit == | == Halit == | ||
In den Abbildungen 1-3 erkennen | In den Abbildungen 1-3 sind Halitkristalle zu erkennen, die neben KCl die einzigen isotropen und damit dem kubischen Kristallsystem angehörenden Salze sind. Im Umkehrschluss gilt nicht, dass alle auf einem Objekträger isotrop erscheinen Kristalle auch kubisch sind wie Halit und Sylvin, da manche Salze, auf dem Objektträger derart orientiert auskrisallisieren, dass sie optisch isotrop erscheinen. Hier ist also Vorsicht geboten. Zusammen mit den typisch kubischen Kristallformen ist die Beobachtung jedoch eindeutig. | ||
<dpl> | |||
category = Halit&Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:optOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
| Zeile 42: | Zeile 46: | ||
== Calciumchlorid == | == Calciumchlorid == | ||
Calciumchlorid | Calciumchlorid kristallisiert nur bei relativ niedriger relativer Luftfeuchte (bei Reinsalzen bei RH < 30,8% bei 20°C) aus. Da die relative Luftfeuchte an den Objekten und auch im Laborraum meist über diesem Wert liegt, ist Calciumchlorid nur selten kristallin am Objekt zu beobachten. Um die Kristalle unter der Polarisationsmikroskop zu beobachten, besteht die Möglichkeit, den Objektträger soweit zu erwärmen, bis sich Kristalle bilden. Diese lösen sich jedoch beim Abkühlen rasch wieder in der Luftfeuchte. In den Abbildungen 4-6 sind Calciumchloridkristalle nach dem Erwärmen abgebildet. | ||
<dpl> | |||
category = Antarcticit&Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:optOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
<gallery caption="Calciumchlorid aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Calciumchlorid aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image:HJS_Ca%28Cl%292_100903-10-7.jpg|Abbildung | Image:HJS_Ca%28Cl%292_100903-10-7.jpg|Abbildung 4: Calciumchloridkristalle unter polarisiertem Licht | ||
Image:HJS_Ca%28Cl%292_100903-10-6.jpg|Abbildung | Image:HJS_Ca%28Cl%292_100903-10-6.jpg|Abbildung 5: Calciumchloridkristalle unter polarisiertem Licht mit Analysator | ||
Image:HJS_Ca%28Cl%292_100903-10-1.jpg|Abbildung | Image:HJS_Ca%28Cl%292_100903-10-1.jpg|Abbildung 6: Calciumchloridkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
</gallery> | </gallery> | ||
== Niter == | == Niter == | ||
<dpl> | |||
category = Niter&Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:optOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
<gallery caption="Niter aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Niter aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image:HJS_KNO3_092503-6.jpg|unter polarisiertem Licht | Image:HJS_KNO3_092503-6.jpg|Abbildung 7:Kalumnitratkristalle unter polarisiertem Licht | ||
Image:HJS_KNO3_092503-5.jpg|unter polarisiertem Licht mit Analysator | Image:HJS_KNO3_092503-5.jpg|Abbildung 8:Kalumnitratkristalle unter polarisiertem Licht mit Analysator | ||
Image:HJS_KNO3_092503-4.jpg|unter polarisiertem Licht mit Analysator und Rot I | Image:HJS_KNO3_092503-4.jpg|Abbildung 9:Kalumnitratkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
</gallery> | </gallery> | ||
== Calciumnitrat == | == Calciumnitrat == | ||
<dpl> | |||
category = Nitrocalcit&Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:optOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
<gallery caption="Calciumnitrat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Calciumnitrat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image:HJS_Ca%28NO3%292_101703-4-6.jpg|unter polarisiertem Licht | Image:HJS_Ca%28NO3%292_101703-4-6.jpg|Abbildung 10:Calciumnitratkristalle unter polarisiertem Licht | ||
Image:HJS_Ca%28NO3%292_101703-4-5.jpg|unter polarisiertem Licht mit Analysator | Image:HJS_Ca%28NO3%292_101703-4-5.jpg|Abbildung 11:Calciumnitratkristalle unter polarisiertem Licht mit Analysator | ||
Image:HJS_Ca%28NO3%292_101703-4-4.jpg|unter polarisiertem Licht mit Analysator und Rot I | Image:HJS_Ca%28NO3%292_101703-4-4.jpg|Abbildung 12:Calciumnitratkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
</gallery> | </gallery> | ||
== Magnesiumnitrat == | == Magnesiumnitrat == | ||
<dpl> | |||
category = Nitromagnesit&Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:optOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
<gallery caption="Magnesiumnitrat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Magnesiumnitrat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image:MgNO3-2_%283%29-klein.jpg|unter polarisiertem Licht | Image:MgNO3-2_%283%29-klein.jpg|Abbildung 13:Magnesiumnitratkristalle unter polarisiertem Licht | ||
Image:|unter polarisiertem Licht mit Analysator | Image:|unter polarisiertem Licht mit Analysator | ||
Image:Mg-NO3-2_%281%29.jpg|unter polarisiertem Licht mit Analysator und Rot I | Image:Mg-NO3-2_%281%29.jpg|Abbildung 14:Magnesiumnitratkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
</gallery> | </gallery> | ||
== Gips == | == Gips == | ||
<dpl> | |||
category = Gips&Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:optOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
<gallery caption="Gips aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Gips aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image:NaCl_%2BGips_9.5.2006_(9).jpg|unter polarisiertem Licht | Image:NaCl_%2BGips_9.5.2006_(9).jpg|Abbildung 15:Calciumsulfatkristalle unter polarisiertem Licht | ||
Image:NaCl_%2BGips_9.5.2006_(8).jpg|unter polarisiertem Licht mit Analysator | Image:NaCl_%2BGips_9.5.2006_(8).jpg|Abbildung 16:Calciumsulfatkristalle unter polarisiertem Licht mit Analysator | ||
Image:NaCl_%2BGips_9.5.2006_(7).jpg|unter polarisiertem Licht mit Analysator und Rot I | Image:NaCl_%2BGips_9.5.2006_(7).jpg|Abbildung 17:Calciumsulfatkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
</gallery> | </gallery> | ||
== Magnesiumsulfat == | == Magnesiumsulfat == | ||
<dpl> | |||
category = Epsomit&Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:optOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
<gallery caption="Magnesiumsulfat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Magnesiumsulfat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image:MgSO4_29-5-2010_17.JPG|unter polarisiertem Licht | Image:MgSO4_29-5-2010_17.JPG|Abbildung 18:Magnesiumsulfatkristalle unter polarisiertem Licht | ||
Image:MgSO4_29-5-2010_16.JPG|unter polarisiertem Licht mit Analysator | Image:MgSO4_29-5-2010_16.JPG|Abbildung 19:Magnesiumsulfatkristalle unter polarisiertem Licht mit Analysator | ||
Image:MgSO4_29-5-2010_(15).JPG|unter polarisiertem Licht mit Analysator und Rot I | Image:MgSO4_29-5-2010_(15).JPG|Abbildung 20:Magnesiumsulfatkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
Image:HJS_MgSO4_092503-5.jpg|unter polarisiertem Licht | Image:HJS_MgSO4_092503-5.jpg|Abbildung 21:Magnesiumsulfatkristalle unter polarisiertem Licht | ||
Image:HJS_MgSO4_092503-4.jpg|unter polarisiertem Licht mit Analysator | Image:HJS_MgSO4_092503-4.jpg|Abbildung 22:Magnesiumsulfatkristalle unter polarisiertem Licht mit Analysator | ||
Image:HJS_MgSO4_092503-3.jpg|unter polarisiertem Licht mit Analysator und Rot I | Image:HJS_MgSO4_092503-3.jpg|Abbildung 23:Magnesiumsulfatkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
Image:CeS_221209-04-2,5kx-03.JPG|Kristallisierter Lösungstropfen unter polarisiertem Licht | Image:CeS_221209-04-2,5kx-03.JPG|Abbildung 24: Kristallisierter Lösungstropfen von Magnesiumsulfat unter polarisiertem Licht | ||
Image:CeS_221209-04-2,5kx-02.JPG|Kristallisierter Lösungstropfen unter polarisiertem Licht mit Analysator | Image:CeS_221209-04-2,5kx-02.JPG|Abbildung 25:Kristallisierter Lösungstropfen von Magnesiumsulfat unter polarisiertem Licht mit Analysator | ||
Image:CeS_221209-04-2,5kx-01.JPG|Kristallisierter Lösungstropfen unter polarisiertem Licht mit Analysator und Rot I | Image:CeS_221209-04-2,5kx-01.JPG|Abbildung 26:Kristallisierter Lösungstropfen von Magnesiumsulfat unter polarisiertem Licht mit Analysator und Rot I | ||
</gallery> | </gallery> | ||
== Natriumsulfat == | == Natriumsulfat == | ||
<dpl> | |||
category = Natriumsulfat&Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:optOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
<gallery caption="Natriumsulfat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Natriumsulfat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image:NaNO3 pol 02.JPG|unter polarisiertem Licht | Image:NaNO3 pol 02.JPG|Abbildung 27 :unter polarisiertem Licht | ||
Image:NaNO3 pol analy 02.jpg|unter polarisiertem Licht Ausschnitt von vorherigem Foto | Image:NaNO3 pol analy 02.jpg|Abbildung 28 :unter polarisiertem Licht Ausschnitt von vorherigem Foto | ||
Image:NaNO3 pol+analy rot I 02.jpg|unter polarisiertem Licht mit Analysator und Rot I | Image:NaNO3 pol+analy rot I 02.jpg|Abbildung 29 :Natriumsulfatkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
Image:HJS_Na2SO4_092503-4.jpg|unter polarisiertem Licht | Image:HJS_Na2SO4_092503-4.jpg|Abbildung 30:Natriumsulfatkristalle unter polarisiertem Licht | ||
Image:HJS_Na2SO4_092503-3.jpg|unter polarisiertem Licht Ausschnitt von vorherigem Foto | Image:HJS_Na2SO4_092503-3.jpg|Abbildung 31:Natriumsulfatkristalle unter polarisiertem Licht Ausschnitt von vorherigem Foto | ||
Image:|unter polarisiertem Licht mit Analysator und Rot I | Image:|unter polarisiertem Licht mit Analysator und Rot I | ||
</gallery> | </gallery> | ||
| Zeile 114: | Zeile 172: | ||
== Natriumcarbonat == | == Natriumcarbonat == | ||
<dpl> | |||
category = Natrit&Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:optOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
<gallery caption="Natriumcarbonat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Natriumcarbonat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image:HJS_Na2CO3_092903-5.jpg|unter polarisiertem Licht | Image:HJS_Na2CO3_092903-5.jpg|Abbildung 32: Natriumcarbonatkristalle unter polarisiertem Licht | ||
Image:HJS_Na2CO3_092903-4.jpg|unter polarisiertem Licht Ausschnitt von vorherigem Foto | Image:HJS_Na2CO3_092903-4.jpg|Abbildung 33: Natriumcarbonatkristalle unter polarisiertem Licht Ausschnitt von vorherigem Foto | ||
Image:HJS_Na2CO3_092903-3.jpg|unter polarisiertem Licht mit Analysator und Rot I | Image:HJS_Na2CO3_092903-3.jpg|Abbildung 34: Natriumcarbonatkristalle unter polarisiertem Licht mit Analysator und Rot I | ||
</gallery> | </gallery> | ||
== Natriumacetat == | == Natriumacetat == | ||
<!-- | |||
<dpl> | |||
category = Natriumacetat &Salz | |||
include ={Infobox_Salz}:chemFormel:Doppelbrechung:Brechungsindices:Kristallsystem:OoptOrientierung | |||
table=class="wikitable sortable",Salz,chemische Formel,Doppelbrechung,Brechungsindices,Kristallsystem,optische Orientierung | |||
tablerow=bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%%,bgcolor=lightyellow align=center|%% | |||
</dpl> | |||
--> | |||
<gallery caption="Natriumacetat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | <gallery caption="Natriumacetat aus wässriger Lösung auf einem Objektträger kristallisiert" widths="200px" heights="150px" perrow="3"> | ||
Image: Natriumacetat_2010.JPG|unter polarisiertem Licht | Image: Natriumacetat_2010.JPG|Abbildung 35: Natriumacetatkristalle unter polarisiertem Licht | ||
Image: Natriumacetat_2010 (1).JPG|unter polarisiertem Licht Ausschnitt von | Image: Natriumacetat_2010 (1).JPG|Abbildung 36: Natriumacetatkristalle unter polarisiertem Licht, Ausschnitt von Abb. 35 | ||
Image: Natriumacetat_2010 (2).JPG|unter polarisiertem Licht mit Analysator und Rot I | Image: Natriumacetat_2010 (2).JPG|Abbildung 37: Natriumacetatkristalle unter polarisiertem Licht mit Analysator und Rot I, Ausschnitt von Abb. 35 | ||
</gallery> | </gallery> | ||
[[Category:LichtMikroskopie]] | |||
<!-- | |||
== Weblinks == | |||
--> | |||
<references/> | |||
[[Category:LichtMikroskopie]] [[Category:Schwarz,Hans-Jürgen]] [[Category:R-MSteiger]] [[Category:R-CBlaeuer]] [[Category:Review]] | |||
Aktuelle Version vom 2. Juli 2012, 14:55 Uhr
Autor: Hans-Jürgen Schwarz
zurück zu Verfahren zur Salzanalyse
Abstract[Bearbeiten]
Die Bestimmung von Salzen mit einem Polarisationsmikroskop wird beschrieben.
Vorgehensweise[Bearbeiten]
Die Untersuchung von Salzen kann auf unterchiedliche Art erfolgen. Wichtig ist jedoch, dass immer sowohl die Anionen und Kationen bestimmt werden, wenn möglich auch die Phasen, das heist die Salze selbst. Bei der üblichen chemischen Analyse wird in der Regel das Carbonat-Ion nicht bestimmt, so dass auch die entsprechenden Salze dann oft nicht gefunden werden, obwohl sie in vielen Fällen die Hauptsalze sein können.
Zwei unterschiedliche Herangehensweisen zur mikroskopischen Salzanalyse werden hier vorgestellt.
Die eine Art der Untersuchung von Salzen bezieht sich auf die Analyse des Salzes an sich, so wie es vom Objekt als Salzktristall genommen wurde. Die andere Möglichkeit analysiert die aus einer wässrigen Lösung auskristallsierenden Salze, sei es, indem man die Salzkristalle in Lösung bringt, oder indem man einen wässrigen Auszug eines Baustoffes erstellt. Beides führt zu Salzkristallisationen, die im Folgenden beschrieben werden und sich je nach Salztyp mehr oder weniger unterscheiden können. Siehe hierzu auch das Kapitel Mikrochemie.
Bestimmung von Einzelsalzen aus dem wässrigen Auszug[Bearbeiten]
Vor der eigentlichen Salzbestimmung wird die zu untersuchende Probe, ob Reinsalz oder Materialprobe, mit wenigen Tropfen destilliertem Wasser versetzt und ein wässriger Auszug nach Bläuer erstellt. Von diesem werden mehrere Tropfen auf einen Objektträger gebracht und unter dem Polarisationsmikroskop beobachtet. Wichtig ist, dass man die Auskristallisation der Salze aus der Lösung von Anfang an, also mit den ersten kleinen Kristallen, bis zum Ende der Krisatllisation beobachtet. Nur dann können die richtigen Schlüsse gezogen werden, da z.B zu Beginn auskristallisierende Salze durch nachfolgende komplett überdeckt und somit am Ende der Kristallisation kaum noch erkannt und bestimmt werden können. Von großer Bedeutung ist deshalb auch die Möglichkeit der kontinulierlichen Dokumentaion dessen, was man beobachtet.
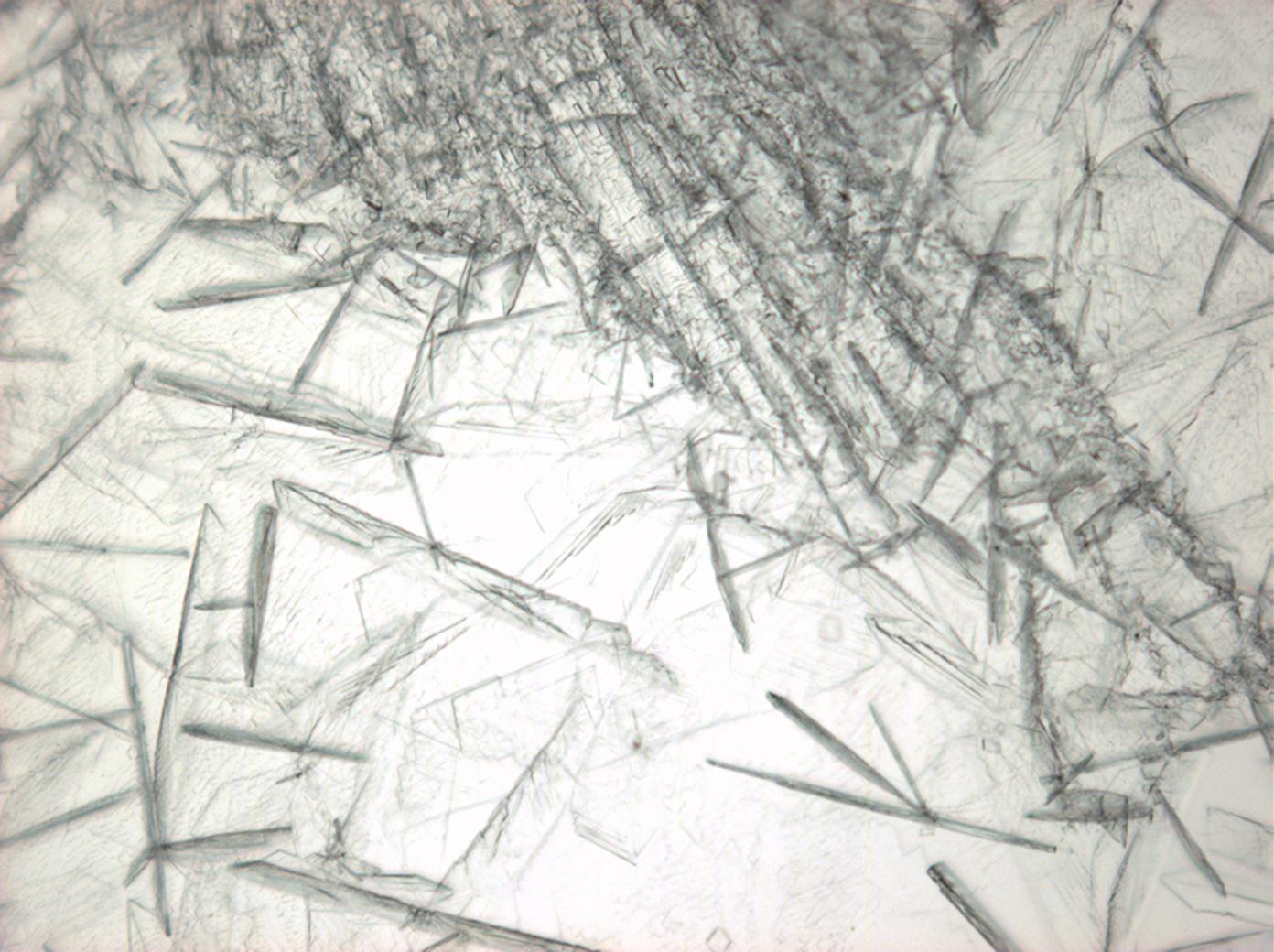
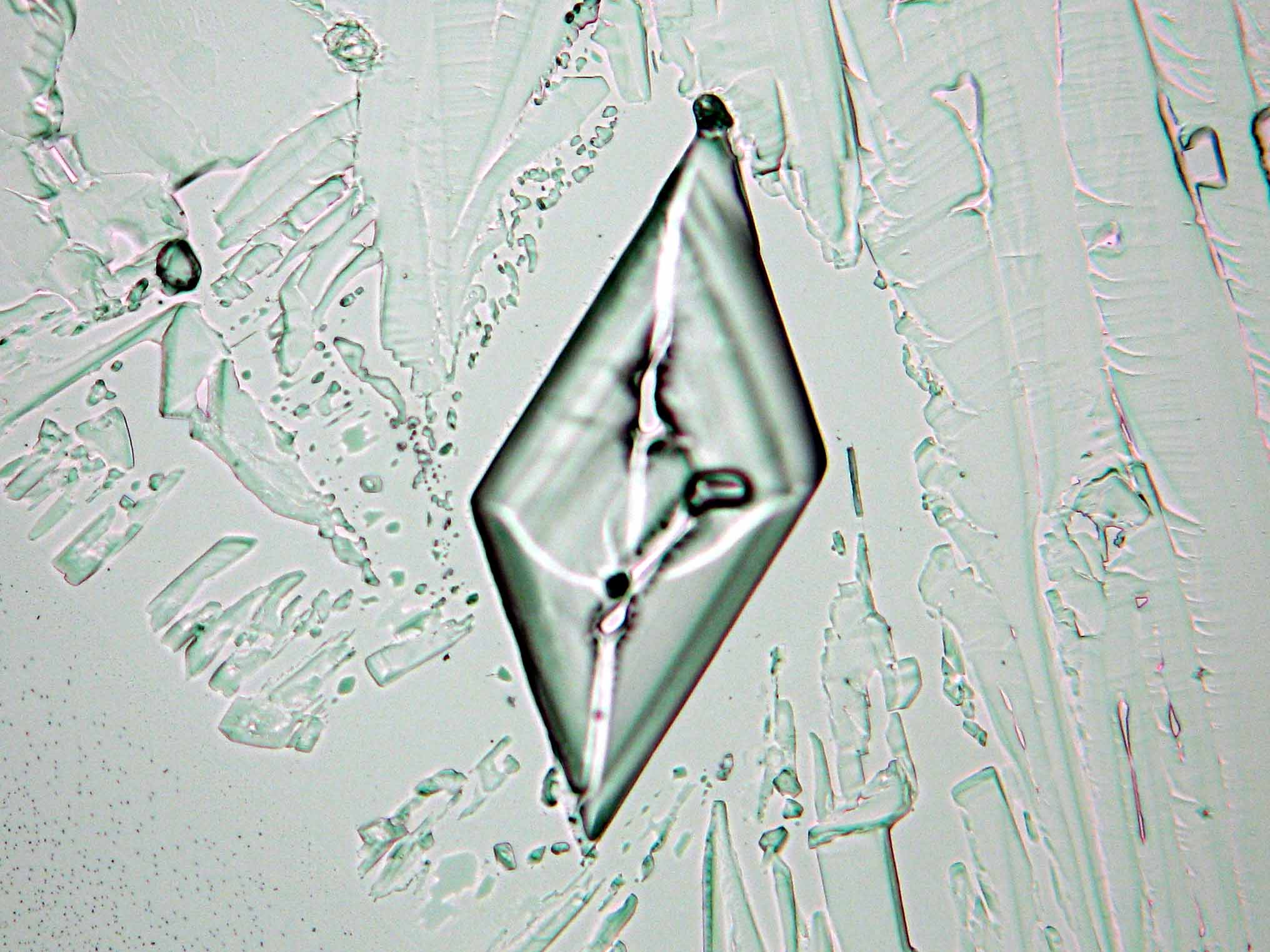
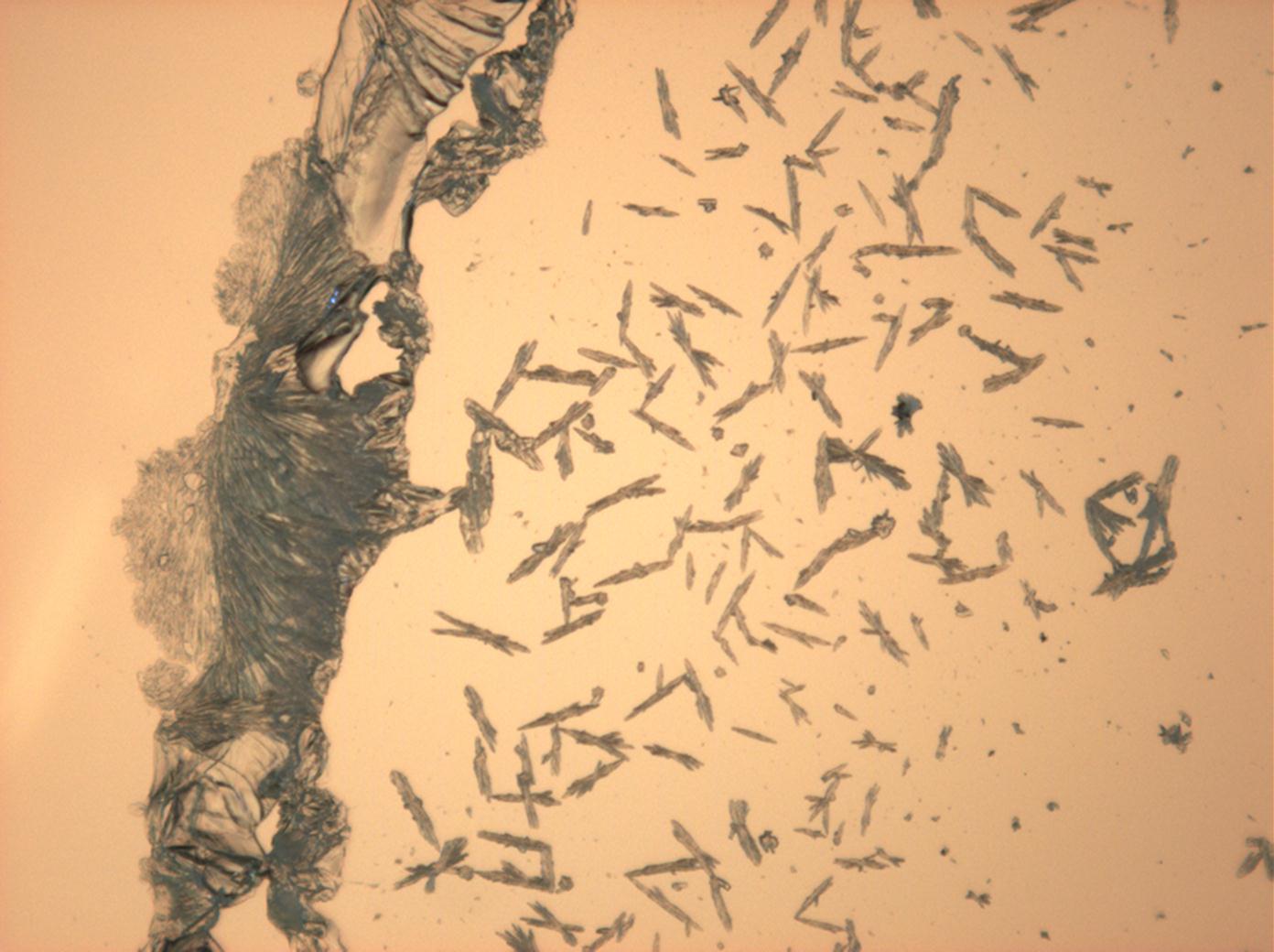
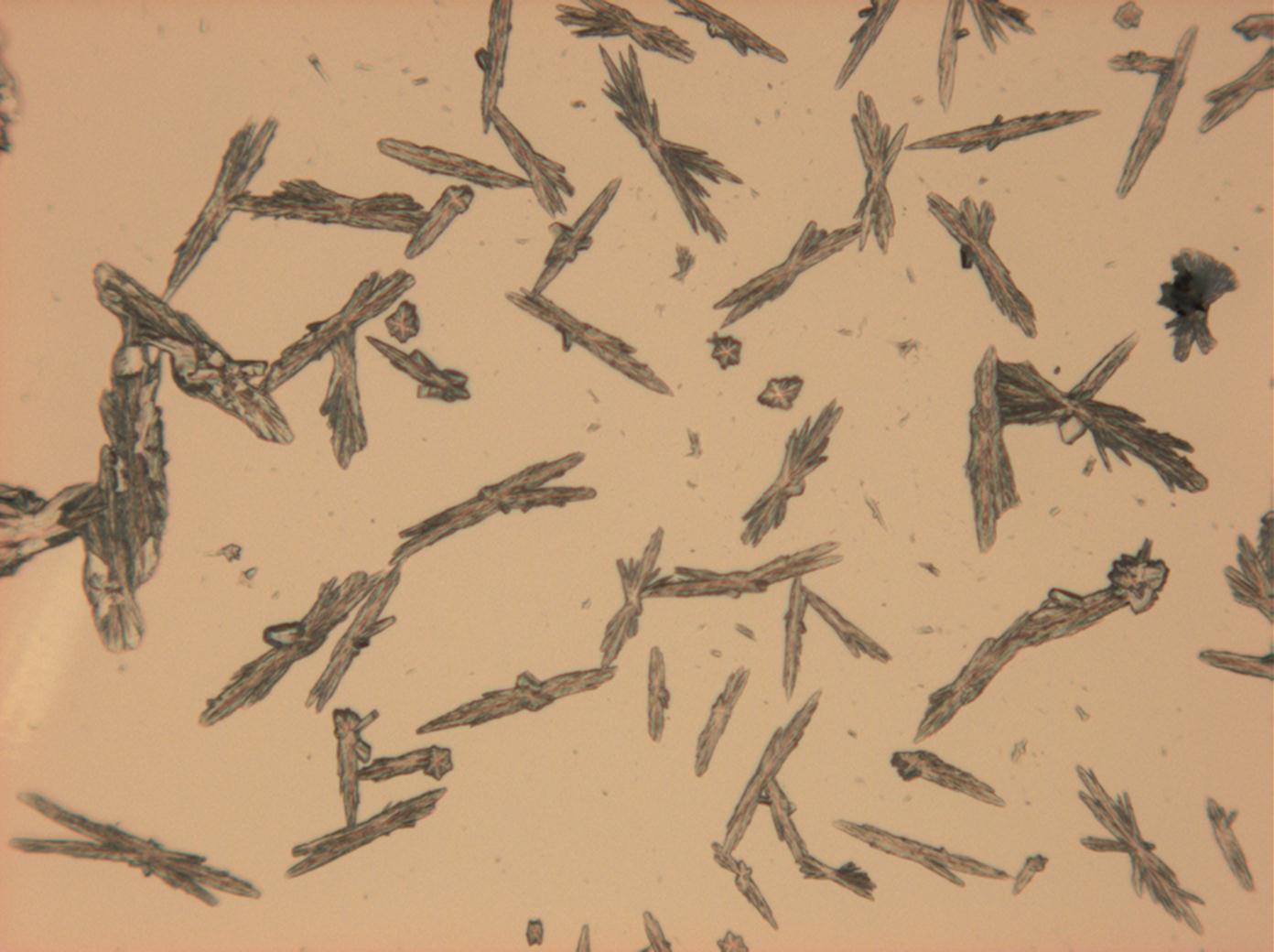
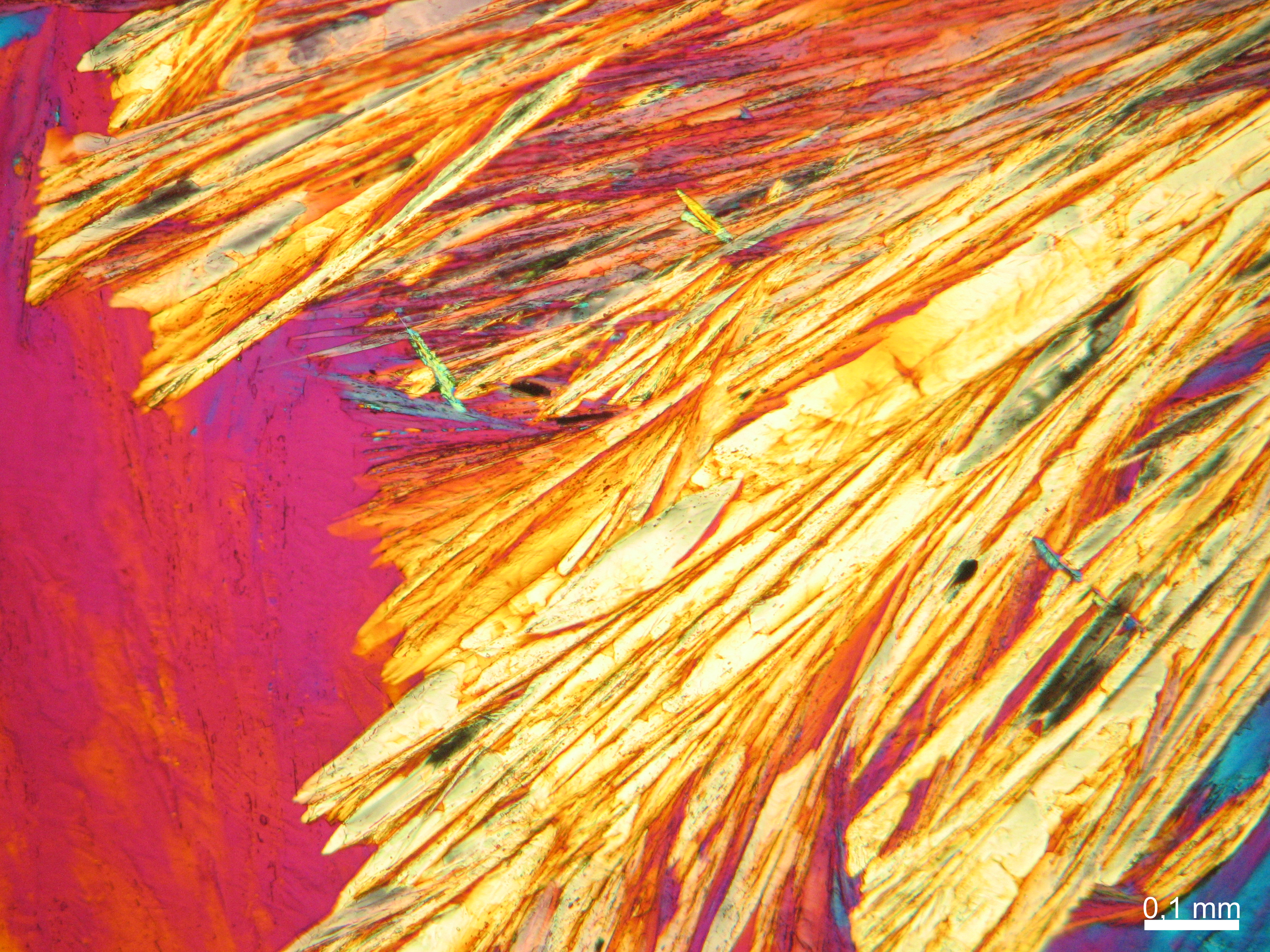
Halit[Bearbeiten]
In den Abbildungen 1-3 sind Halitkristalle zu erkennen, die neben KCl die einzigen isotropen und damit dem kubischen Kristallsystem angehörenden Salze sind. Im Umkehrschluss gilt nicht, dass alle auf einem Objekträger isotrop erscheinen Kristalle auch kubisch sind wie Halit und Sylvin, da manche Salze, auf dem Objektträger derart orientiert auskrisallisieren, dass sie optisch isotrop erscheinen. Hier ist also Vorsicht geboten. Zusammen mit den typisch kubischen Kristallformen ist die Beobachtung jedoch eindeutig.
| Salz | chemische Formel | Doppelbrechung | Brechungsindices | Kristallsystem | optische Orientierung |
|---|---|---|---|---|---|
| Test | NaCl | nD=1,544 | kubisch | isotrop | |
| Halit | NaCl | nD=1,5443 | kubisch | isotrop |
- Halit aus wässriger Lösung auf einem Objektträger kristallisiert
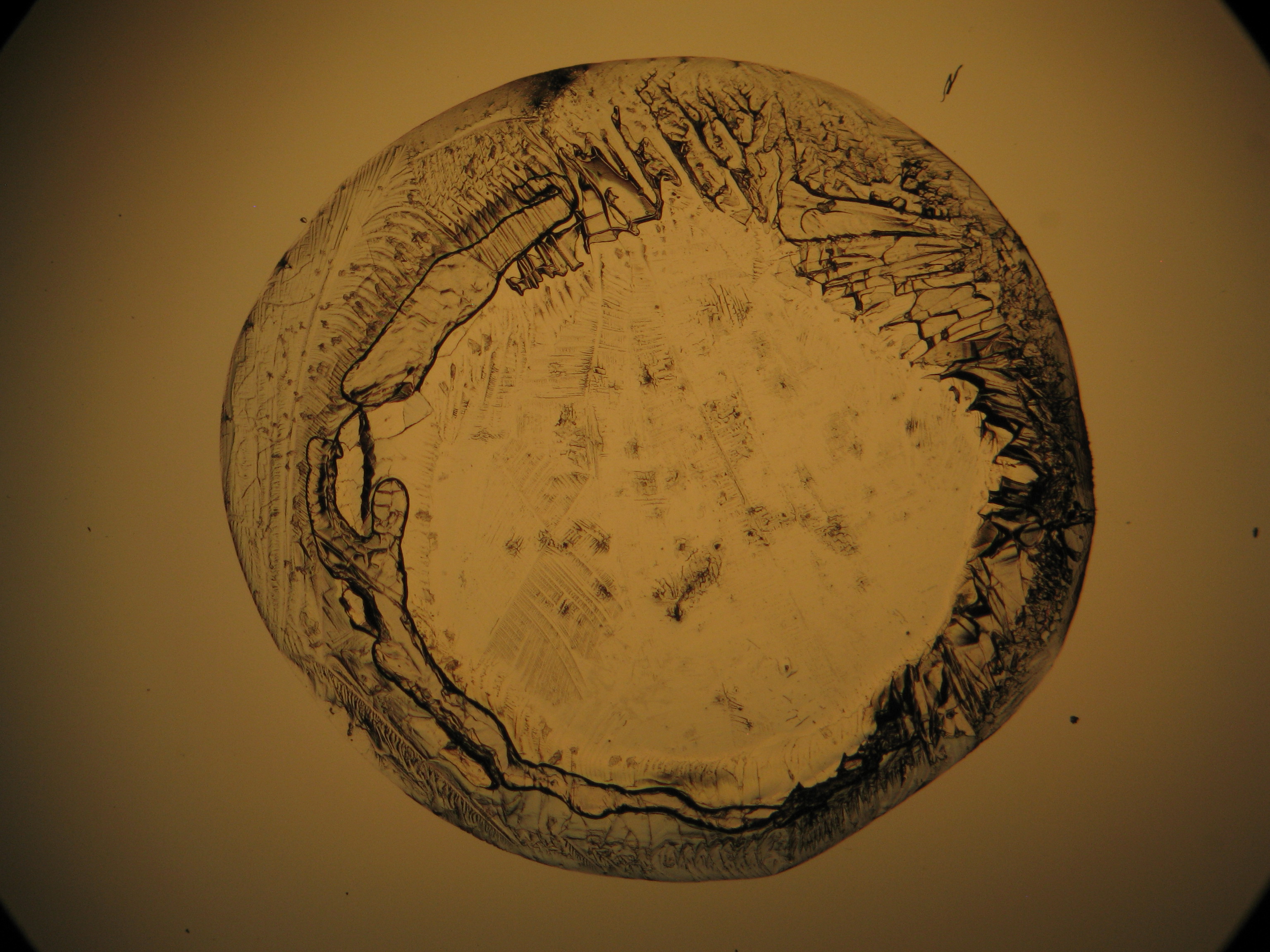
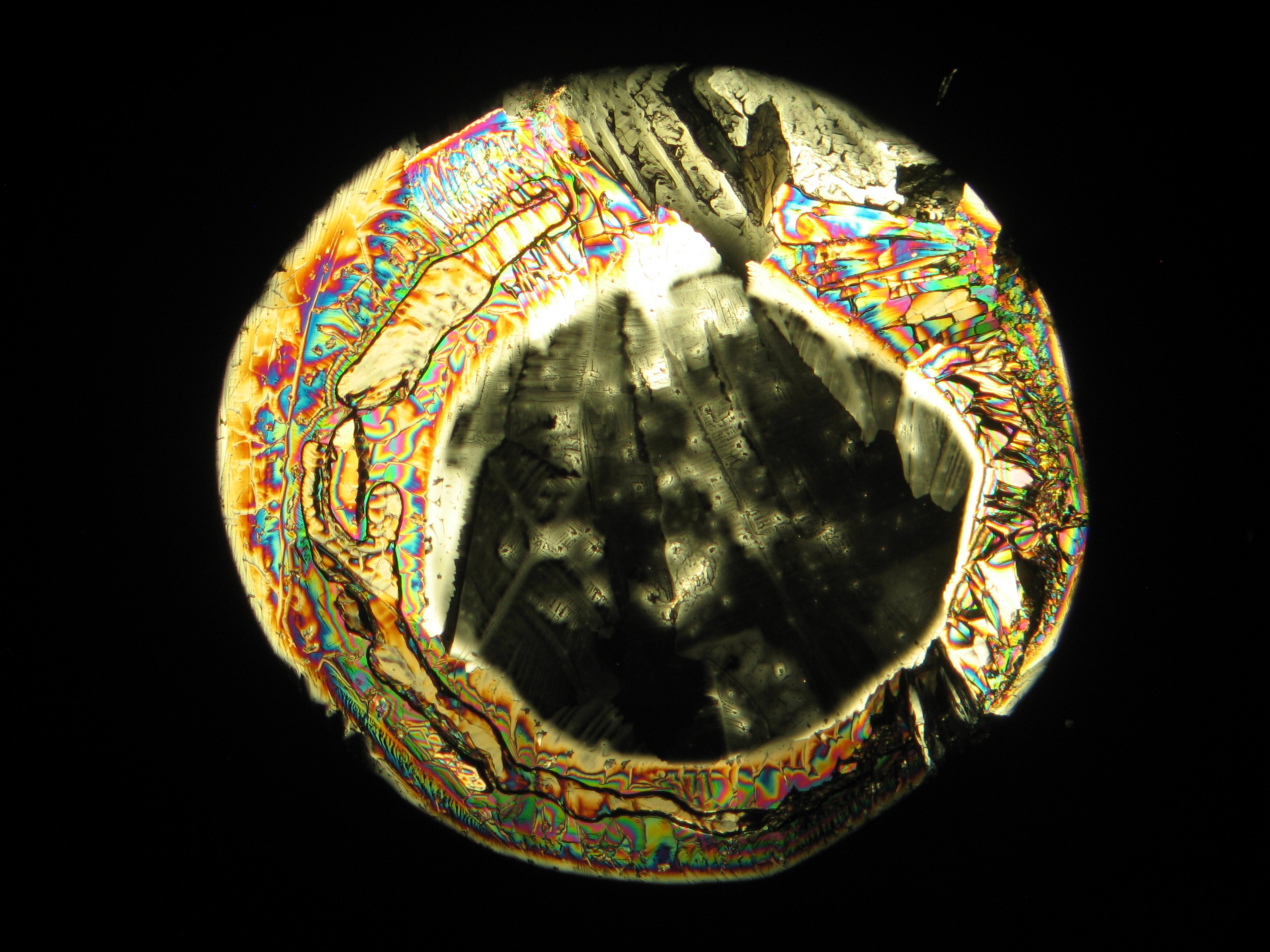
Calciumchlorid[Bearbeiten]
Calciumchlorid kristallisiert nur bei relativ niedriger relativer Luftfeuchte (bei Reinsalzen bei RH < 30,8% bei 20°C) aus. Da die relative Luftfeuchte an den Objekten und auch im Laborraum meist über diesem Wert liegt, ist Calciumchlorid nur selten kristallin am Objekt zu beobachten. Um die Kristalle unter der Polarisationsmikroskop zu beobachten, besteht die Möglichkeit, den Objektträger soweit zu erwärmen, bis sich Kristalle bilden. Diese lösen sich jedoch beim Abkühlen rasch wieder in der Luftfeuchte. In den Abbildungen 4-6 sind Calciumchloridkristalle nach dem Erwärmen abgebildet.
| Salz | chemische Formel | Doppelbrechung | Brechungsindices | Kristallsystem | optische Orientierung |
|---|---|---|---|---|---|
| Antarcticit | CaCl2•6H2O | Δ= 0,055 | no =1,417-1,495 ne = 1,393-1,550 |
trigonal | einachsig negativ |
- Calciumchlorid aus wässriger Lösung auf einem Objektträger kristallisiert
Niter[Bearbeiten]
| Salz | chemische Formel | Doppelbrechung | Brechungsindices | Kristallsystem | optische Orientierung |
|---|---|---|---|---|---|
| Niter | KNO3 | Δ = 0,171 | nx = 1,335 ny = 1,505 nz = 1,506 |
orthorhombisch | zweiachsig negativ |
- Niter aus wässriger Lösung auf einem Objektträger kristallisiert
Calciumnitrat[Bearbeiten]
| Salz | chemische Formel | Doppelbrechung | Brechungsindices | Kristallsystem | optische Orientierung |
|---|---|---|---|---|---|
| Nitrocalcit | Ca(NO3)2•4H2O | Δ = 0,039 | nx = 1,465 ny = 1,498 nz = 1,504 |
monoklin | negativ |
- Calciumnitrat aus wässriger Lösung auf einem Objektträger kristallisiert
Magnesiumnitrat[Bearbeiten]
| Salz | chemische Formel | Doppelbrechung | Brechungsindices | Kristallsystem | optische Orientierung |
|---|---|---|---|---|---|
| Nitromagnesit | Mg(NO3)2•6H2O | Δ = 0,166 | nx = 1,34 ny = 1,506 nz = 1,506 |
monoklin | negativ |
- Magnesiumnitrat aus wässriger Lösung auf einem Objektträger kristallisiert
Gips[Bearbeiten]
| Salz | chemische Formel | Doppelbrechung | Brechungsindices | Kristallsystem | optische Orientierung |
|---|---|---|---|---|---|
| Gips | CaSO4•2 H2O | Δ = 0,0092 | nx = 1,5207 ny = 1,5230 nz = 1,5299 |
monoklin | zweiachsig positiv |
- Gips aus wässriger Lösung auf einem Objektträger kristallisiert
Magnesiumsulfat[Bearbeiten]
| Salz | chemische Formel | Doppelbrechung | Brechungsindices | Kristallsystem | optische Orientierung |
|---|---|---|---|---|---|
| Epsomit | MgSO4•7H2O | Δ = 0,0284 | nx = 1,432 ny = 1,453 nz = 1,4609 |
orthorhombisch | zweiachsig negativ |
- Magnesiumsulfat aus wässriger Lösung auf einem Objektträger kristallisiert
Natriumsulfat[Bearbeiten]
| Salz | chemische Formel | Doppelbrechung | Brechungsindices | Kristallsystem | optische Orientierung |
|---|---|---|---|---|---|
| Thenardit | Na2SO4 | Δ = 0,013 | nx = 1,471 ny = 1,477 nz = 1,484 |
orthorhombisch | positiv |
| Natriumsulfat-Heptahydrat | Na2SO4•7H2O | ||||
| Natriumsulfat | |||||
| Mirabilit | Na2SO4•10H2O | Δ = 0,004 | nx = 1,394 ny = 1,396 nz = 1,398 |
monoklin | negativ |
| Natriumsulfat Phase III | Na2SO4 |
- Natriumsulfat aus wässriger Lösung auf einem Objektträger kristallisiert
Natriumcarbonat[Bearbeiten]
| Salz | chemische Formel | Doppelbrechung | Brechungsindices | Kristallsystem | optische Orientierung |
|---|---|---|---|---|---|
| Natrit | Na2CO3 | Δ = 0,131 | nx = 1,415 ny = 1,535 nz = 1,546 |
monoklin | zweiachsig negativ |
- Natriumcarbonat aus wässriger Lösung auf einem Objektträger kristallisiert
Natriumacetat[Bearbeiten]
- Natriumacetat aus wässriger Lösung auf einem Objektträger kristallisiert