Bischofit: Unterschied zwischen den Versionen
Zur Navigation springen
Zur Suche springen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (20 dazwischenliegende Versionen von 4 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autoren: Hans-Jürgen [[Benutzer:Hschwarz|Schwarz]] | Autoren: Hans-Jürgen [[Benutzer:Hschwarz|Schwarz]] | ||
<br>zurück zu [[Chloride]] | <br>zurück zu [[Chloride]] | ||
{{Infobox_Salz | {{Infobox_Salz | ||
|Footnote=<ref> http://webmineral.com/data/Bischofite.shtml gesehen 29.07.2010</ref><ref> http://www.mindat.org/min-681.html gesehen 29.07.2010</ref><ref> http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Bischofit | |Footnote=<ref> http://webmineral.com/data/Bischofite.shtml gesehen 29.07.2010</ref><ref> http://www.mindat.org/min-681.html gesehen 29.07.2010</ref><ref> http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Bischofit gesehen 29.07.2010</ref> | ||
|bild = | |bild = <!--[[Image:"Name der Bilddatei"|300px]] --> | ||
|mineralogischerName=Bischofit | |mineralogischerName=Bischofit | ||
|chemischerName =Magnesiumchlorid Hexahydrat | |chemischerName =Magnesiumchlorid Hexahydrat | ||
| Zeile 11: | Zeile 10: | ||
|chemFormel =MgCl<sub>2</sub>•6H<sub>2</sub>O | |chemFormel =MgCl<sub>2</sub>•6H<sub>2</sub>O | ||
|Hydratformen = | |Hydratformen = | ||
| | |Kristallsystem =monoklin | ||
|Deliqueszenzfeuchte = | |Deliqueszenzfeuchte =33,1% | ||
|Löslichkeit= | |Löslichkeit=5,75 mol/kg | ||
|Dichte =1, | |Dichte =1,57 g/cm<sup>3</sup> | ||
|Molvolumen =129,6 cm<sup>3</sup>/mol | |Molvolumen =129,6 cm<sup>3</sup>/mol | ||
|Molgewicht = 203, | |Molgewicht = 203,30 g/mol | ||
|Transparenz = | |Transparenz = | ||
|Spaltbarkeit =keine | |Spaltbarkeit =keine | ||
|Kristallhabitus = | |Kristallhabitus = | ||
|Zwillingsbildung = | |Zwillingsbildung = | ||
|Brechungsindices = n<sub>x</sub> =1, | |Brechungsindices = n<sub>x</sub> =1,495<br> n<sub>y</sub> = 1,509<br> n<sub>z</sub> = 1,528 | ||
|Doppelbrechung =Δ = 0, | |Doppelbrechung =Δ = 0,003 | ||
|optOrientierung=positiv | |optOrientierung=positiv | ||
|Pleochroismus = | |Pleochroismus = | ||
|Dispersion = | |Dispersion =79° | ||
|Phasenübergang = | |Phasenübergang = | ||
|chemVerhalten = | |chemVerhalten = | ||
|Bemerkungen = | |Bemerkungen =zersetzt sich bei 116-118°C<br>hygroskopisch bis zerfließend | ||
|Literatur=<bib id="Steiger.etal:2014"/> <bib id="Broul.etal:1981"/> <bib id="Dana:1951"/> <bib id="Steiger.etal:2011a"/> | |||
}} | }} | ||
<!-- | <!-- | ||
| Zeile 52: | Zeile 52: | ||
<br> (vgl.Tabelle [[Hygroskopizität der Salze und Gleichgewichtsfeuchte]]) | <br> (vgl.Tabelle [[Hygroskopizität der Salze und Gleichgewichtsfeuchte]]) | ||
--> | |||
== Lösungsverhalten == | |||
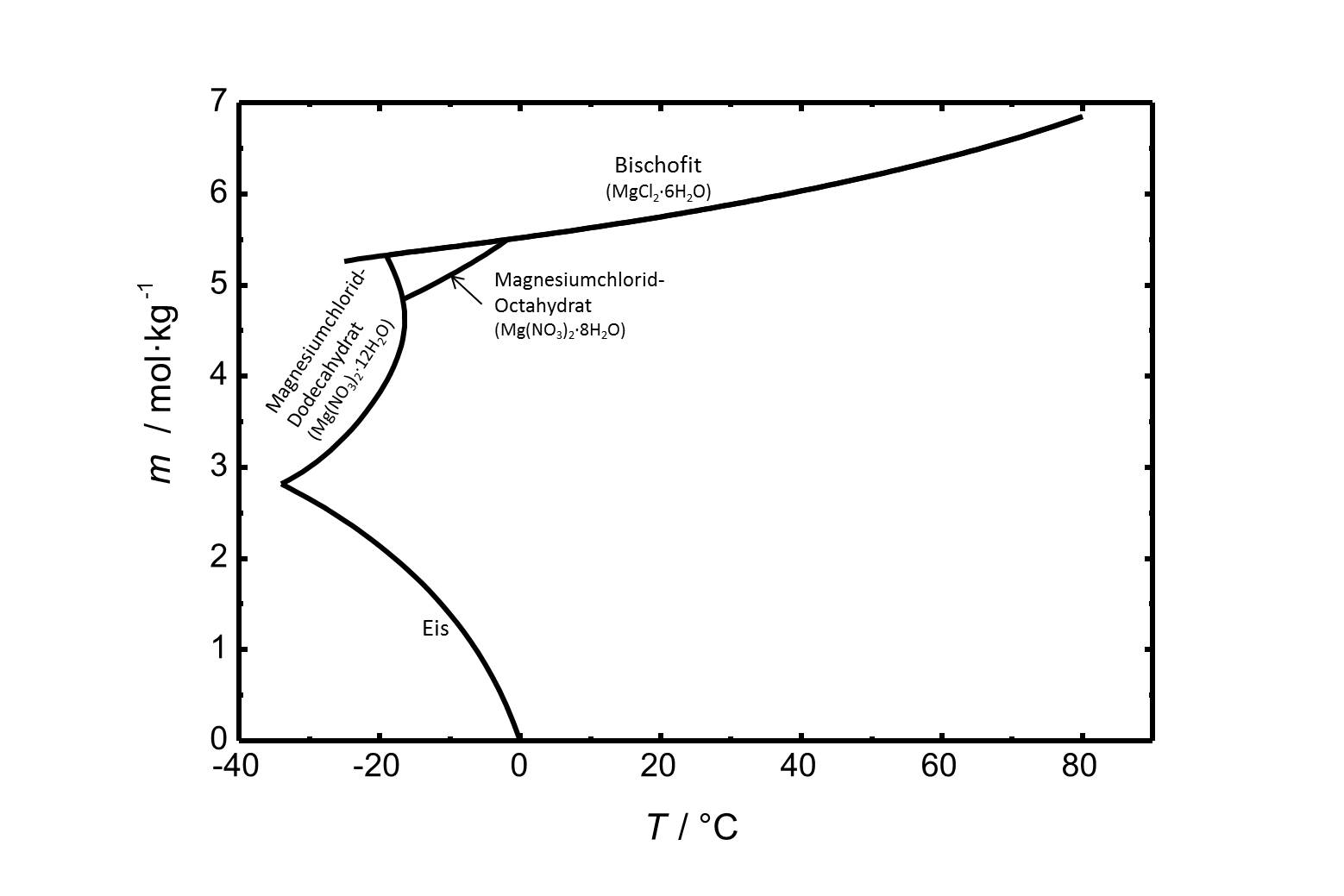
Die Löslichkeit von Magnesiumchlorid in Wasser im Temperaturbereich von -40 bis 80 °C ist in Abbildung 1 gezeigt. Die Löslichkeit von Bischofit bei 20 °C beträgt 5,75 mol/kg. | |||
[[Image:MgCl2 L.jpg|thumb|left|800px|Abbildung 1:Löslichkeit von Magnesiumchlorid in Wasser. Aufgetragen ist die Molalität ''m'' [n(MgCl<sub>2</sub>)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur.]] <br clear=all> | |||
== | ==Hygroskopizität== | ||
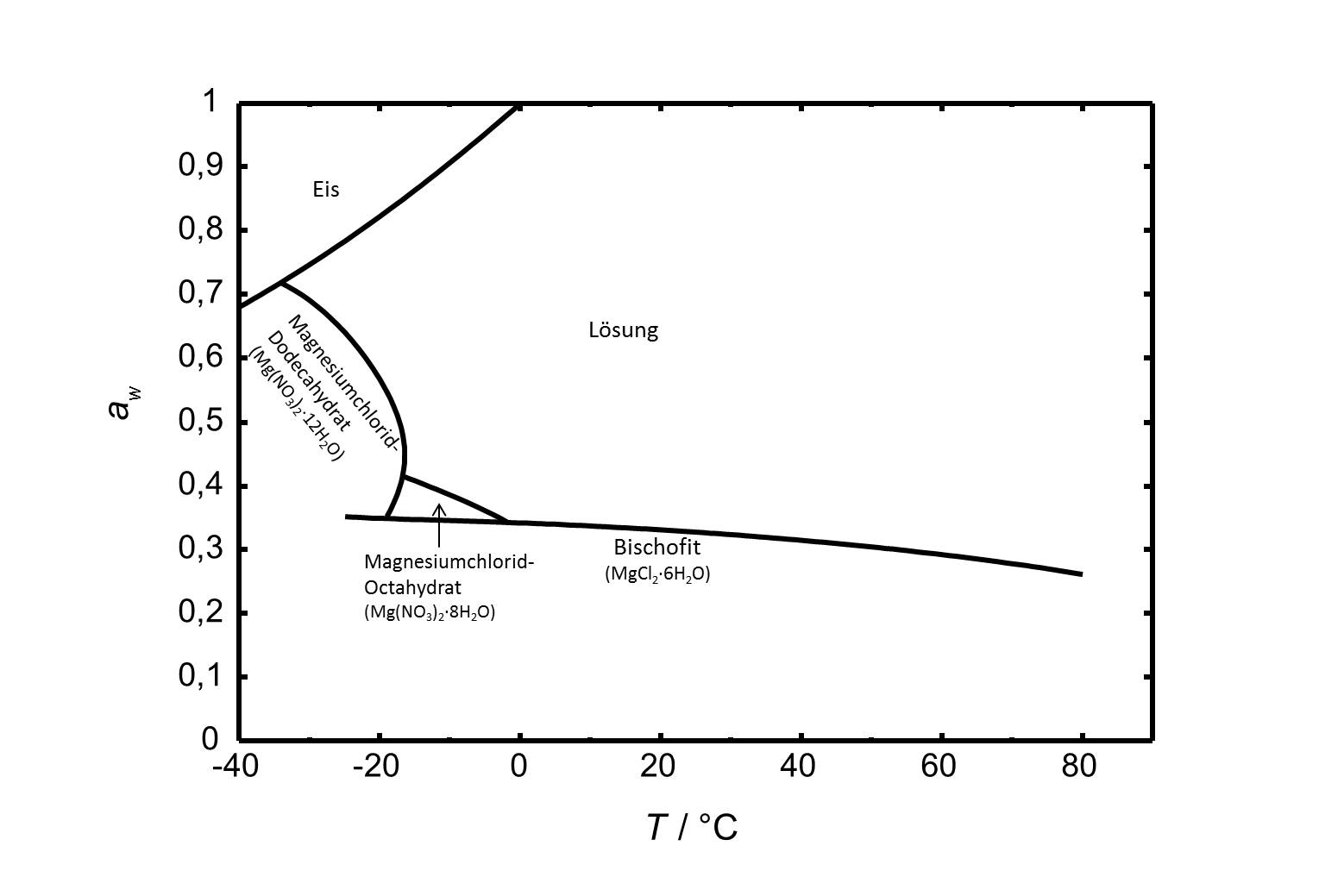
Das Phasendiagramm des Systems MgCl<sub>2</sub>-H<sub>2</sub>O ist in Abbildung 2 gezeigt. Neben Bischofit gibt es in dem betrachteten Temperaturbereich von -40 bis 80 °C noch zwei weitere stabile Hydratstufen. Das Octa- und das Dodecahydrat sind bei niedrigen Temperaturen relevant.<br clear=all> | |||
[[Image:D MgCl2 d.jpg|thumb|left|800px|Abbildung 2: Phasendiagramm des Systems MgCl<sub>2</sub>-H<sub>2</sub>O im Temperaturbereich von -40 bis 80 °C. Aufgetragen ist die Wasseraktivität ''a<sub>w</sub>'' gegen die Temperatur.]] | |||
<br clear=all> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 1: Deliqueszenzfeuchte von Bischofit in Temperaturabhängigkeit nach <bib id="Steiger.etal:2014"/>'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| 0°C | |||
|bgcolor = "#F0F0F0" align=center| 10°C | |||
|bgcolor = "#F0F0F0" align=center| 20°C | |||
|bgcolor = "#F0F0F0" align=center| 30°C | |||
|bgcolor = "#F0F0F0" align=center| 40°C | |||
|bgcolor = "#F0F0F0" align=center| 50°C | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| 34,1%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 33,7%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 33,1%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 32,4%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 31,5%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 30,5%r.F. | |||
|} | |||
<br clear=all> | |||
<!-- | |||
'''Feuchtesorption:'''<br> | '''Feuchtesorption:'''<br> | ||
(vgl. Tabelle [[Gleichgewichtsfeuchte in Abhängigkeit von Temperatur]]) | (vgl. Tabelle [[Gleichgewichtsfeuchte in Abhängigkeit von Temperatur]]) | ||
| Zeile 115: | Zeile 146: | ||
<references /> | <references /> | ||
== Literatur == | == Literatur == | ||
<biblist/> | |||
[[Category:Bischofit]] [[Category: | [[Category:Bischofit]] [[Category:Chlorid]] [[Category:Salz]] [[Category:Schwarz,Hans-Jürgen]] [[Category:R-MSteiger]] [[Category:Bearbeitung]] | ||
[[Category:Liste]] | |||
Aktuelle Version vom 3. Mai 2023, 11:50 Uhr
Autoren: Hans-Jürgen Schwarz
zurück zu Chloride
| Bischofit[1][2][3] | |
| Mineralogische Salzbezeichnung | Bischofit |
| Chemische Bezeichnung | Magnesiumchlorid Hexahydrat |
| Trivialname | |
| Chemische Formel | MgCl2•6H2O |
| Hydratformen | |
| Kristallsystem | monoklin |
| Deliqueszenzfeuchte 20°C | 33,1% |
| Löslichkeit(g/l) bei 20°C | 5,75 mol/kg |
| Dichte (g/cm³) | 1,57 g/cm3 |
| Molares Volumen | 129,6 cm3/mol |
| Molare Masse | 203,30 g/mol |
| Transparenz | |
| Spaltbarkeit | keine |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | zersetzt sich bei 116-118°C hygroskopisch bis zerfließend |
| Kristalloptik | |
| Brechungsindices | nx =1,495 ny = 1,509 nz = 1,528 |
| Doppelbrechung | Δ = 0,003 |
| Optische Orientierung | positiv |
| Pleochroismus | |
| Dispersion | 79° |
| Verwendete Literatur | |
| [Steiger.etal:2014]Titel: Weathering and Deterioration Autor / Verfasser: Steiger, Michael; Charola A. Elena; Sterflinger, Katja  [Broul.etal:1981]Titel: Solubility in organic two component systems [Broul.etal:1981]Titel: Solubility in organic two component systemsAutor / Verfasser: Broul M., Nyvlt J.; Soehnel O.  [Dana:1951]Titel: Dana's System of Mineralogy [Dana:1951]Titel: Dana's System of MineralogyAutor / Verfasser: Dana J.D.  [Steiger.etal:2011a]Titel: Decomposition reactions of magnesium sulfate hydrates and phase equilibria in the MgSO4-H2O and Na+-Mg2+-Cl--SO42--H2O systems with implications for Mars [Steiger.etal:2011a]Titel: Decomposition reactions of magnesium sulfate hydrates and phase equilibria in the MgSO4-H2O and Na+-Mg2+-Cl--SO42--H2O systems with implications for MarsAutor / Verfasser: Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M. 
| |
Lösungsverhalten[Bearbeiten]
Die Löslichkeit von Magnesiumchlorid in Wasser im Temperaturbereich von -40 bis 80 °C ist in Abbildung 1 gezeigt. Die Löslichkeit von Bischofit bei 20 °C beträgt 5,75 mol/kg.
Hygroskopizität[Bearbeiten]
Das Phasendiagramm des Systems MgCl2-H2O ist in Abbildung 2 gezeigt. Neben Bischofit gibt es in dem betrachteten Temperaturbereich von -40 bis 80 °C noch zwei weitere stabile Hydratstufen. Das Octa- und das Dodecahydrat sind bei niedrigen Temperaturen relevant.
| 0°C | 10°C | 20°C | 30°C | 40°C | 50°C |
| 34,1%r.F. | 33,7%r.F. | 33,1%r.F. | 32,4%r.F. | 31,5%r.F. | 30,5%r.F. |
Weblinks[Bearbeiten]
- ↑ http://webmineral.com/data/Bischofite.shtml gesehen 29.07.2010
- ↑ http://www.mindat.org/min-681.html gesehen 29.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Bischofit gesehen 29.07.2010
Literatur[Bearbeiten]
| [Broul.etal:1981] | Elsevier (Hrsg.) Broul M., Nyvlt J.; Soehnel O. (1981): Solubility in organic two component systems, Elsevier |  |
| [Dana:1951] | Dana E.S. (Hrsg.) Dana J.D. (1951): Dana's System of Mineralogy, 7, Wiley & Sons |  |
| [Steiger.etal:2011a] | Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M. (2011): Decomposition reactions of magnesium sulfate hydrates and phase equilibria in the MgSO4-H2O and Na+-Mg2+-Cl--SO42--H2O systems with implications for Mars. In: Geochimica et Cosmochimica Act, 75 (12), 3600-3626, https://doi.org/10.1016/j.gca.2011.03.038 |  |
| [Steiger.etal:2014] | Steiger, Michael; Charola A. Elena; Sterflinger, Katja (2014): Weathering and Deterioration. In: Siegesmund S.; Snethlage R. (Hrsg.): Stone in Architecture, Springer Verlag Berlin Heidelberg, 223-316, Webadresse, https://doi.org/10.1007/978-3-642-45155-3_4. |  |