Thenardit: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (89 dazwischenliegende Versionen von 7 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autoren: [[Benutzer:Hschwarz|Hans-Jürgen Schwarz ]], [[Benutzer:MSteiger|Michael Steiger]], [[Benutzer:TMueller|Tim Müller]] <br> | |||
zurück zu [[Sulfate]] | |||
{{Infobox_Salz | |||
|Footnote=<ref>http://webmineral.com/data/Thenardite.shtml gesehen 29.07.2010</ref><ref>http://www.mindat.org/min-3935.html gesehen 29.07.2010</ref><ref> | |||
http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Thenardit gesehen 29.07.2010</ref> | |||
|bild =[[Datei:HJS-Na2SO4-111703-02-10x.jpg|300px]] | |||
|mineralogischerName=Thenardit | |||
|chemischerName =Natriumsulfat | |||
|Trivialname =Phase V, Makit, Menardit, Pyrotechnit | |||
|chemFormel =Na<sub>2</sub>SO<sub>4</sub> | |||
|Hydratformen =[[Mirabilit]] (Na<sub>2</sub>SO<sub>4</sub>•10H<sub>2</sub>O)<br> [[Natriumsulfat-Heptahydrat]] (Na<sub>2</sub>SO<sub>4</sub>•7H<sub>2</sub>O) | |||
|Kristallsystem =orthorhombisch | |||
|Deliqueszenzfeuchte = 86,6 % | |||
|Löslichkeit=3,706 mol/kg | |||
|Dichte =2,689 g/cm³ | |||
|Molvolumen =53,11 cm<sup>3</sup>/mol | |||
|Molgewicht =142,04 g/mol | |||
|Transparenz =durchsichtig | |||
|Spaltbarkeit = vollkommen | |||
|Kristallhabitus = | |||
|Zwillingsbildung = | |||
|Brechungsindices = n<sub>x</sub> = 1,471<br> n<sub>y</sub> = 1,477<br> n<sub>z</sub> = 1,484 | |||
|Doppelbrechung =Δ = 0,013 | |||
|optOrientierung=positiv | |||
|Pleochroismus = | |||
|Dispersion = 82,5° | |||
|Phasenübergang = | |||
|chemVerhalten = | |||
|Bemerkungen =löslich in Wasser und Glycerin, <br>in wasserfreiem Ethanol unlöslich | |||
|Literatur = <bib id="Robie.etal:1978"/> <bib id="Dana:1951"/> | |||
}} | |||
= | = Natriumsulfat und Thenardit = | ||
__TOC__ | |||
== Abstract == | |||
Thenardit als wasserfreie Phase des Natriumsulfats und seine Eigenschaften sollen vorgestellt werden. | |||
== Vorkommen == | |||
Sowohl Thenardit wie auch [[Mirabilit]] erscheinen als natürliche Mineralien. In Mineralwässern, als Ablagerungen ehemaliger Salzseen und in Form unterschiedlicher Doppelsalze tritt Natriumsulfat in der Natur auf. Die Kenntnis des kristallwasserhaltigen Natriumsulfates reicht nachweislich bis in das 16. Jh. zurück. Erste Beschreibungen desselben sind von Glauber aus dem Jahre 1658 überliefert, welcher es als “sal mirable” bezeichnete. Auf dessen Namen zurückgehend ist auch die Trivialbezeichnung “Glaubersalz” für [[Mirabilit]] in der Literatur anzutreffen. | |||
== Angaben zu Herkunft und Bildung von Thenardit/Mirabilit an Baudenkmalen == | |||
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumsulfat als Ausblühsalz entstehen, wenn mit schwefeligen Gasen kontaminierte Luft einwirkt oder sonstige Sulfatquellen vorliegen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch können 100 kg Portlandzement mit einem Gehalt von lediglich 0,1% löslichem Na<sub>2</sub>O in schwefelsäurehaltiger Luft 520g [[Mirabilit]] ausbilden [Angaben nach Arnold/Zehnder 1991]. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendeten Restaurierungsprodukten (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächenwasser anzuführen, die Na<sup>+</sup>-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem [[Halit|Natriumchlorid]]. In Küstennähe ist [[Halit|NaCl]]-haltiges Meerwasser als Natriumquelle zu berücksichtigen. | |||
== Lösungsverhalten == | == Lösungsverhalten == | ||
[[Datei:L Na2SO4.jpg|thumb|800px|left|'''Abbildung 1''': Löslichkeiten im System Na<sub>2</sub>SO<sub>4</sub>-H<sub>2</sub>O in Abhängigkeit der Temperatur, nach <bib id="Steiger.etal:2008"/>.]] | |||
<br clear=all> | |||
Thenardit ist unterhalb von 32,4 °C metastabil. Mit einer Löslichkeit von 3,7 mol/kg bei 20°C gehört es zu den leichtlöslichen Salzen und somit auch zu den leicht mobilisierbaren Salzen (vgl.Tabelle [[Hygroskopizität der Salze und Gleichgewichtsfeuchte]]). Die Löslichkeit von Thenardit weist wie auch die der anderen Phasen im System Na<sub>2</sub>SO<sub>4</sub>-H<sub>2</sub>O eine Temperaturabhängigkeit auf. Mit dem starken Einfluß der Temperatur auf die Löslichkeit von Thenardit ist die Gefahr einer Lösungsübersättigung bezüglich [[Mirabilit]] bei raschem Temperaturabfall und Kristallisation von Mirabilit verbunden.<br> | |||
Siehe hierzu auch [[Natriumsulfat]]. | |||
== Hygroskopizität == | == Hygroskopizität == | ||
[[Datei:D Na2SO4 d.jpg|thumb|800px|left|'''Abbildung 2''':Deliqueszenzfeuchten im System Na<sub>2</sub>SO<sub>4</sub>-H<sub>2</sub>O, sowie Gleichgewichtsfeuchten der Thenardit-Mirabilit-Umwandlung. Nach <bib id="Steiger.etal:2008"/>]] | |||
<br clear=all> | |||
In Abbildung 2 ist der Temperatureinfluß auf die Deliqueszenzfeuchten von Thenardit sowie der anderen Phasen des Natriusulfats verdeutlicht. Auffällig sind hierbei die gegenläufigen Kurvenverläufe der Deliqueszenz von Thenardit und [[Mirabilit]]. Siehe hierzu auch [[Natriumsulfat]]. | |||
Die Deliqueszenzfeuchte von Thenardit verschiebt sich bei steigender Temperatur zu höheren Werten (s. Tabelle 1). | |||
<br clear=all> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 1: Deliqueszenzfeuchte von Thenardit in Temperaturabhängigkeit nach <bib id="Steiger.etal:2008"/>'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| 0°C | |||
|bgcolor = "#F0F0F0" align=center| 10°C | |||
|bgcolor = "#F0F0F0" align=center| 20°C | |||
|bgcolor = "#F0F0F0" align=center| 30°C | |||
|bgcolor = "#F0F0F0" align=center| 40°C | |||
|bgcolor = "#F0F0F0" align=center| 50°C | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| 84,4%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 85,6%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 86,6%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 87,3%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 87,9%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 88,4%r.F. | |||
|} | |||
<br clear=all> | |||
In Anwesenheit von Fremdionen (bei Salzgemischen) verändern sich die Parameter der Gleichgewichtsfeuchte und der notwendigen Temperatur- und Feuchtebedingungen für Umkristallisationen zudem deutlich. Als orientierende Daten sind in der unteren Tabelle experimentell erfaßte Werte der Gleichgewichtsfeuchte in unterschiedlichen Salzgemischen wiedergegeben. Es zeigt sich, daß alle Werte der Gleichgewichtsfeuchte unter denen des Reinsalzes Mirabilit liegen. | In Anwesenheit von Fremdionen (bei Salzgemischen) verändern sich die Parameter der Gleichgewichtsfeuchte und der notwendigen Temperatur- und Feuchtebedingungen für Umkristallisationen zudem deutlich. Als orientierende Daten sind in der unteren Tabelle experimentell erfaßte Werte der Gleichgewichtsfeuchte in unterschiedlichen Salzgemischen wiedergegeben. Es zeigt sich, daß alle Werte der Gleichgewichtsfeuchte unter denen des Reinsalzes Mirabilit liegen (vgl. Tabelle [[Gleichgewichtsfeuchte in Abhängigkeit von Temperatur]]). <br> | ||
{| cellspacing=" | <br clear="all"> | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 2''' - Angaben der Gleichgewichtsfeuchten über gesättigten Mischlösungen (Mischungsverhältnis: Gesättigte Lsg.A/ gesättigte Lsg.B =1:1) <bib id="Vogt.etal:1993"/>'' | |||
|- | |- | ||
| | |bgcolor = "#F0F0F0" | | ||
| | |bgcolor = "#F0F0F0" align="center"| '''MgSO<sub>4</sub>''' | ||
| | |bgcolor = "#F0F0F0" align="center"| '''Ca(NO<sub>3</sub>)<sub>2</sub>''' | ||
| | |bgcolor = "#F0F0F0" align="center"| '''KNO<sub>3</sub>''' | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7" | '''Na<sub>2</sub>SO<sub>4</sub> • 10H<sub>2</sub>O''' | ||
| | |bgcolor = "#FFFFEO" align="center"| 87(21°C) | ||
| | |bgcolor = "#FFFFEO" align="center"| 74 (21°C) | ||
| | |bgcolor = "#FFFFEO" align="center"| 81(21°C) | ||
|} | |} | ||
<br clear="all"> | |||
'''Feuchtesorption: ''' | '''Feuchtesorption: ''' | ||
Als weitere Angabe zur Abschätzung der Hygroskopizität von Thenardit sind in der nachstehenden Tabelle Werte für das Sorptionsverhalten des Reinsalzes und des Gemisches mit [[Halit]] bei unterschiedlichen relativen Feuchten wiedergegeben: | |||
{| cellspacing=" | <br> | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="center" class="wikitable" | |||
|+''Tabelle 3''': Feuchtsorption in M.% nach 56 Tagen Lagerung von Natriumsulfat [nach <bib id="Vogt.etal:1993"/>]'' | |||
|- | |- | ||
| Lagerungsfeuchte | |bgcolor = "#F0F0F0" | '''Lagerungsfeuchte''' | ||
| | |bgcolor = "#F0F0F0" align="center"| '''87% r.F.''' | ||
| | |bgcolor = "#F0F0F0" align="center"| '''81% r.F.''' | ||
| | |bgcolor = "#F0F0F0" align="center"| '''79% r.F.''' | ||
|- | |- | ||
| Na<sub>2</sub>SO<sub>4</sub> | |bgcolor = "#F7F7F7" | '''Na<sub>2</sub>SO<sub>4</sub>''' | ||
| | |bgcolor = "#FFFFEO" align="center"| 79 | ||
| | |bgcolor = "#FFFFEO" align="center"| 0 | ||
| | |bgcolor = "#FFFFEO" align="center"| 0 | ||
|- | |- | ||
| Na<sub>2</sub>SO<sub>4</sub>+NaCl (1:1 molare Mischung) | |bgcolor = "#F7F7F7" | '''Na<sub>2</sub>SO<sub>4</sub>+NaCl''' (1:1 molare Mischung) | ||
| | |bgcolor = "#FFFFEO" align="center"| 157 | ||
| | |bgcolor = "#FFFFEO" align="center"| 32 | ||
| | |bgcolor = "#FFFFEO" align="center"| 15 | ||
|} | |} | ||
== Kristallisationsdruck == | == Kristallisationsdruck == | ||
Bei der Kristallisation aus wäßriger Lösung läßt sich für Thenardit ein Kristallisationsdruck von 29,2-34,5 N/mm<sup>2</sup> angeben. Im Vergleich mit den berechneten Angaben der Kristallisationsdrücke anderer bauschädlichen Salze kann Thenardit einen hohen Kristallisationsdruck aufbauen <bib id=Winkler:1975/>. | Bei der Kristallisation aus wäßriger Lösung läßt sich für Thenardit ein Kristallisationsdruck von 29,2-34,5 N/mm<sup>2</sup> angeben. Im Vergleich mit den berechneten Angaben der Kristallisationsdrücke anderer bauschädlichen Salze kann Thenardit einen hohen Kristallisationsdruck aufbauen <bib id="Winkler:1975"/>. | ||
== Hydratationsverhalten == | == Hydratationsverhalten == | ||
[[Datei:Mirabilit Thenardit.ogg|thumb|400px|right|Umwandlung von Mirabilit(?) in Thenardit]] | |||
Das System Na<sub>2</sub>SO<sub>4</sub> – H<sub>2</sub>O: | Das System Na<sub>2</sub>SO<sub>4</sub> – H<sub>2</sub>O: | ||
Als nachweisbare, stabile Hydratstufen existieren lediglich das Anhydrit (Thenardit) und das Dekahydrat ([[Mirabilit]]). Die Erzeugung von Mirabilit kann durch Rekristallisation des Salzes aus übersättigter, wäßriger Lösung bei einer Temperatur von unter 32,4°C erfolgen. Insbesondere aufgrund der Hydratstufenbildung, der mit einem Einbau von 10 Wassermolekülen in das Kristallgitter und einer Volumenexpansion von rund 320% verbunden ist und der niedrigen Übergangstemperatur von ca. 32-35°C zählen Natriumsulfate zu den sehr verwitterungsaktiven Schadsalzen. Auch dieser Wert ist als Richtwert zu verstehen. Der Phasenübergang Mirabilit – Thenardit kann bei einer Temperatur von 25 °C bei einer relativen Feuchte von ca. 80% stattfinden, beträgt die Umgebungstemperatur 0°C, so ist ein Übergang bereits bei einer r.F. von 60,7% möglich [Angaben nach Gmelin]. Es zeigt sich also auch hier ein starker Temperatureinfluß. Eine Abschätzung der Schadensaktivität durch Kristallisations- und Hydratationsprozesse der Natriumsulfate wird sich an einem Bauwerk bei varierenden Einflußgrößen also sehr schwierig darstellen, da die Klimaparameter das Verhalten extrem beeinflussen. | Als nachweisbare, stabile Hydratstufen existieren lediglich das Anhydrit (Thenardit) und das Dekahydrat ([[Mirabilit]]). Die Erzeugung von Mirabilit kann durch Rekristallisation des Salzes aus übersättigter, wäßriger Lösung bei einer Temperatur von unter 32,4°C erfolgen. Insbesondere aufgrund der Hydratstufenbildung, der mit einem Einbau von 10 Wassermolekülen in das Kristallgitter und einer Volumenexpansion von rund 320% verbunden ist und der niedrigen Übergangstemperatur von ca. 32-35°C zählen Natriumsulfate zu den sehr verwitterungsaktiven Schadsalzen. Auch dieser Wert ist als Richtwert zu verstehen. Der Phasenübergang [[Mirabilit]] – Thenardit kann bei einer Temperatur von 25 °C bei einer relativen Feuchte von ca. 80% stattfinden, beträgt die Umgebungstemperatur 0°C, so ist ein Übergang bereits bei einer r.F. von 60,7% möglich [Angaben nach Gmelin]. Es zeigt sich also auch hier ein starker Temperatureinfluß. Eine Abschätzung der Schadensaktivität durch Kristallisations- und Hydratationsprozesse der Natriumsulfate wird sich an einem Bauwerk bei varierenden Einflußgrößen also sehr schwierig darstellen, da die Klimaparameter das Verhalten extrem beeinflussen. | ||
<!-- | |||
== Die Bedeutung des Heptahydrat beim Schadensprozess == | |||
--> | |||
== Hydratationsdruck == | == Hydratationsdruck == | ||
Der Hydratationsdruck, der beim Übergang von Thenardit zu Mirabilit aufgebaut wird, ist stark abhängig von den bestehenden Luftfeuchte- und | Der Hydratationsdruck, der beim Übergang von Thenardit zu [[Mirabilit]] aufgebaut wird, ist stark abhängig von den bestehenden Luftfeuchte- und Temperaturverhältnissen, was in der nachstehenden Tabelle verdeutlicht ist: | ||
{| cellspacing=" | <br clear="all"> | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 3''': Hydratationsdruck Thenardit-[[Mirabilit]] nach <bib id="Winkler.etal:1970"/>'' | |||
|- | |- | ||
| | |bgcolor = "#F0F0F0" align=center| '''rel. Feuchte %''' | ||
| | |bgcolor = "#F0F0F0" align=center| '''20,0 °C''' | ||
| | |bgcolor = "#F0F0F0" align=center| '''25,0 °C''' | ||
| | |bgcolor = "#F0F0F0" align=center| '''30,0 °C''' | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7" align=center| '''100''' | ||
| | |bgcolor = "#FFFFEO" align="center"| 48,9 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 40,5 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 28,9 N/mm<sup>2</sup> | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7" align=center| '''95,0''' | ||
| | |bgcolor = "#FFFFEO" align="center"| 41,3 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 32,7 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 23,3 N/mm<sup>2</sup> | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7" align="center"| '''90,0''' | ||
| | |bgcolor = "#FFFFEO" align="center"| 33,5 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 24,9 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 13,7 N/mm<sup>2</sup> | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7" align="center"| '''85,0''' | ||
| | |bgcolor = "#FFFFEO" align="center"| 25,5 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 16,0 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 5,1 N/mm<sup>2</sup> | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7" align="center"| '''80,0''' | ||
| | |bgcolor = "#FFFFEO" align="center"| 16,4 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 7,8 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 0,0 | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7" align="center"| '''75,0''' | ||
| | |bgcolor = "#FFFFEO" align="center"| 6,7 N/mm<sup>2</sup> | ||
| | |bgcolor = "#FFFFEO" align="center"| 0,0 | ||
| | |bgcolor = "#FFFFEO" align="center"| - | ||
|} | |} | ||
<br clear=all> | |||
Die Volumenveränderung, die beim Phasenübergang stattfindet, ist mit ca. 320% anzugeben <bib id="Sperling.etal:1980"/>. | |||
== Analytischer Nachweis == | |||
== | === Mikroskopie<br> === | ||
'''Laboruntersuchung:'''<br>Durch mikroskopische Beobachtungen des Lösungsverhaltens sind die gute Wasserlöslichkeit und Ethanolunlöslichkeit zu verifizieren. Thenardit und [[Mirabilit]] besitzen keine morphologische Charakterisitka, die bei einfachen Rekristallisationsversuchen zur Identifizierung beitragen können. Vielmehr ist eine große Bandbreite unterschiedlichster Erscheinungsformen beobachtbar.<br> | |||
'''Laboruntersuchung:'''<br>Durch mikroskopische Beobachtungen des Lösungsverhaltens sind die gute Wasserlöslichkeit und Ethanolunlöslichkeit zu verifizieren. Thenardit und Mirabilit besitzen keine morphologische Charakterisitka, die bei einfachen Rekristallisationsversuchen zur Identifizierung beitragen können. Vielmehr ist eine große Bandbreite unterschiedlichster Erscheinungsformen beobachtbar.<br> | |||
'''Brechungsindizes:''' n<sub>x</sub> = 1,468; n<sub>y</sub> =1,473; n<sub>z</sub> =1,483<br>'''Doppelbrechung''': Δ = 0.015<br>'''Kristallklass'''e: orthorhombisch<br> | '''Brechungsindizes:''' n<sub>x</sub> = 1,468; n<sub>y</sub> =1,473; n<sub>z</sub> =1,483<br>'''Doppelbrechung''': Δ = 0.015<br>'''Kristallklass'''e: orthorhombisch<br> | ||
| Zeile 220: | Zeile 199: | ||
<br> | <br> | ||
'''Polarisationsmikroskopische Untersuchung:'''<br> | '''[[Polarisationsmikroskopie|Polarisationsmikroskopische]] Untersuchung:'''<br> | ||
In Abhängigkeit von den vorliegenden Luftfeuchte- und Temperaturbedingungen verändern Kristalle des Rohprobematerials und des rekristallisierten Präparates ihren Kristallwassergehalt. An trockner Luft (mit r.F. < 80% und Raumtemperatur) verliert Mirabilit sein Kristallwasser und geht in Thenardit über. Dieser Vorgang kann mikroskopisch klar nachvollzogen werden, wenn der | In Abhängigkeit von den vorliegenden Luftfeuchte- und Temperaturbedingungen verändern Kristalle des Rohprobematerials und des rekristallisierten Präparates ihren Kristallwassergehalt. An trockner Luft (mit r.F. < 80% und Raumtemperatur) verliert [[Mirabilit]] sein Kristallwasser und geht in Thenardit über. Dieser Vorgang kann mikroskopisch klar nachvollzogen werden, wenn der Prozess der Rekristallisation beobachtet wird. [[Mirabilit]] weist charakteristische anormale Interferenzfarbe auf, im Zuge des Wasserverlustes und Entstehen von Thenardit schwächen sich die anormalen Interferenzphänomene zunehmend ab.<br><br>Die Zuweisung der Brechungsindizes von Thenardit erfolgt entsprechend der Immersionsmethode. Aufgrund der niedrigen maximalen Doppelbrechung zeigt Thenardit zumeist graue Interferenzfarben. Die Auslöschung ist parallel oder symmetrisch. | ||
<br>'''Verwechslungsmöglichkeiten:''' | <br>'''Verwechslungsmöglichkeiten:''' | ||
Generell ist die Unterscheidung einer bestimmten Anzahl von Sulfaten (die unten aufgelistet sind und wozu Thenardit zählt) ohne mikrochemische Bestimmung der Anionen problematisch, da die Brechungsindizes der Salze dicht beieinander liegen | Generell ist die Unterscheidung einer bestimmten Anzahl von Sulfaten (die unten aufgelistet sind und wozu Thenardit zählt) ohne mikrochemische Bestimmung der Anionen problematisch, da die Brechungsindizes der Salze dicht beieinander liegen und alle Salze eine niedrige Doppelbrechung aufweisen. Hilfreich ist die Verwendung eines Immersionsmittels mit einem n<sub>D</sub>-Wert von 1,48. Eine Differenzierung innerhalb dieser Gruppe wird damit möglich. Außerdem können die unten genannten Eigenschaften als Abgrenzungskriterien hinzugezogen werden. | ||
Eindeutig bestimmbar wird Thenardit durch die Möglichkeit, nach Auflösung des Probematerials im Zuge der Rekristallisation das Phänomen anormaler Interferezfarben beobachten zu können, sprich Mirabilit in der hohen Hydratstufe zu identifizieren | Eindeutig bestimmbar wird Thenardit durch die Möglichkeit, nach Auflösung des Probematerials im Zuge der Rekristallisation das Phänomen anormaler Interferezfarben beobachten zu können, sprich [[Mirabilit]] in der hohen Hydratstufe zu identifizieren und somit indirekt Thenardit nachzuweisen. | ||
{| cellspacing=" | {|border="2" cellspacing="0" cellpadding="4" width="100%" align="left" class="wikitable" | ||
|+''Tabelle 3''': Unterscheidungsmerkmale zu anderen Sulfaten'' | |||
|- | |- | ||
| '''Salzphase''' | |bgcolor = "#F0F0F0"| '''Salzphase''' | ||
| | |bgcolor = "#F0F0F0"| '''Unterscheidungsmerkmal''' | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7"| '''[[Boussingaultit]]''' (NH<sub>4</sub>)<sub>2</sub>Mg(SO)<sub>4</sub> • 6H<sub>2</sub>0 | ||
| | |bgcolor = "#FFFFEO"| keine anormalen Interferenzfarben / schiefe Auslöschung | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7"| '''[[Schönit|Pikromerit]]''' K<sub>2</sub>Mg(SO<sub>4</sub>)<sub>2</sub> • 6H<sub>2</sub>0 | ||
| | |bgcolor = "#FFFFEO"| keine anormalen Interferenzfarben / schiefe Auslöschung | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7"|'''[[Astrakanit|Bloedit]]''' Na<sub>2</sub>Mg(SO<sub>4</sub>)<sub>2</sub> • 6H<sub>2</sub>0 | ||
| | |bgcolor = "#FFFFEO"| alle Indizes >1,48 / keine anormalen Interferenzfarben / schiefe Auslöschung / optisch negativ orientiert. | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7"| '''[[Aphthitalit|Glaserit]]''' K<sub>3</sub>Na(SO<sub>4</sub>)<sub>2</sub> | ||
| | |bgcolor = "#FFFFEO"| alle Indizes >1,48 / keine anormalen Interferenzfarben/schiefe Auslöschung | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7"| '''[[Arcanit]]''' K<sub>2</sub>SO<sub>4</sub> | ||
| | |bgcolor = "#FFFFEO"| alle Indizes >1,48 / keine anormalen Interferenzfarben | ||
|- | |- | ||
| | |bgcolor = "#F7F7F7"| '''[[Magnesiumformiat]]''' Mg(HCO<sub>2</sub>)<sub>2</sub> • 2H<sub>2</sub>O | ||
| | |bgcolor = "#FFFFEO"| vergleichsweise hohe Doppelbrechung / keine anormalen Interfernzfarben / schiefe Auslöschung | ||
|} | |} | ||
| Zeile 258: | Zeile 238: | ||
'''Betrachtung von Mischsystemen:''' | '''Betrachtung von Mischsystemen:''' | ||
Mischsystem Na<sup>+</sup>– Ca<sup>2+</sup>– SO<sub>4</sub> <sup>2-</sup>: Der Ausfall von Gips erfolgt im Zuge der Rekristallisation entsprechend der geringeren Löslichkeit desselben zuerst. Der charakteristische nadelige Habitus von einzelnen Gipskristallen wie auch von Aggregaten bleibt bestehen. Der Ausfall von Natriumsulfat erfolgt später, das eigentliche Kristallwachstum vollzieht sich merklich schneller. Die Morphologie ist unspezifisch. | Mischsystem Na<sup>+</sup>– Ca<sup>2+</sup>– SO<sub>4</sub> <sup>2-</sup>: Der Ausfall von [[Gips]] erfolgt im Zuge der Rekristallisation entsprechend der geringeren Löslichkeit desselben zuerst. Der charakteristische nadelige Habitus von einzelnen Gipskristallen wie auch von Aggregaten bleibt bestehen. Der Ausfall von Natriumsulfat erfolgt später, das eigentliche Kristallwachstum vollzieht sich merklich schneller. Die Morphologie ist unspezifisch. | ||
Mischsystem Na<sup>+</sup>– SO<sub>4</sub> <sup>2-</sup>– Cl<sup>-</sup>: Der Ausfall der beiden Partikelsorten beginnt etwa zeitgleich. Halit mit charakteristischer Morphologie, Natriumsulfat in extrem variierender Gestalt. | Mischsystem Na<sup>+</sup>– SO<sub>4</sub> <sup>2-</sup>– Cl<sup>-</sup>: Der Ausfall der beiden Partikelsorten beginnt etwa zeitgleich. Halit mit charakteristischer Morphologie, Natriumsulfat in extrem variierender Gestalt. | ||
== | <!-- | ||
=== Röntgendiffraktometrie === | |||
== | === Raman-Stektroskopie === | ||
== | === DTA / TG === | ||
= | === IR-Spektroskopie === | ||
<br> | |||
<br> | |||
<br> | |||
--> | |||
== | == Salze und Salzschäden im Bild == | ||
== | === Am Objekt === | ||
<gallery | <gallery caption="Thenardit Ausblühungen an Objekten" widths="200px" heights="150px" perrow="3"> | ||
Image:Idensen,_Thenardit_ausbluehung_aussen.jpg|Thenaditkristalle auf einer Mauerfuge der Alten Kirche in Idensen | |||
<!--Image:Eilsum_Gipsausbluehungen.jpg|Thenarditausblühungen in der Ev. Ref. Kirche in Eilsum | |||
--> | |||
</gallery> | |||
<!-- | |||
=== Unter dem Polarisationsmikrokop === | |||
<gallery caption="Natriumsulfat-Kristalle zwischen zwei Objektträgern kristallisiert" widths="200px" heights="150px" perrow="3"> | |||
Image:HJS Na2SO4-slides-6.jpg |in einfach polarisiertem Licht | Image:HJS Na2SO4-slides-6.jpg |in einfach polarisiertem Licht | ||
Image:HJS Na2SO4-slides-1.jpg| mit gekreuzten Polarisatoren und Rot I | Image:HJS Na2SO4-slides-1.jpg| mit gekreuzten Polarisatoren und Rot I | ||
| Zeile 296: | Zeile 289: | ||
<br> | <br> | ||
<gallery | <gallery caption="NNatriumsulfat-Kristalle , kristallisiert aus wässriger Lösung von Realproben" widths="200px" heights="150px" perrow="3"> | ||
Image:HJS Na2SO4 092503-3.jpg|in einfach polarisiertem Licht | Image:HJS Na2SO4 092503-3.jpg|in einfach polarisiertem Licht | ||
| Zeile 303: | Zeile 296: | ||
</gallery> | </gallery> | ||
== Unter dem Rasterelektronenmikroskop | === Unter dem Rasterelektronenmikroskop === | ||
--> | |||
= | |||
== Weblinks<br> == | |||
<references /> | |||
== Literatur == | |||
<biblist/> | |||
'''Weitere Literatur''' | |||
<bibprint filter=" title:%Na2SO4%"/> | |||
<bibprint/> | |||
[[Category:Thenardit]][[Category: | [[Category:Natriumsulfat]][[Category:Thenardit]][[Category:Schwarz,Hans-Jürgen]][[Category:R-MSteiger]][[Category:Review]][[Kategorie:Müller,Tim]][[Category:Sulfat]] [[Category:Salz]][[Category:Liste]] | ||
Aktuelle Version vom 2. Mai 2023, 11:41 Uhr
Autoren: Hans-Jürgen Schwarz , Michael Steiger, Tim Müller
zurück zu Sulfate
| Thenardit[1][2][3] | |

| |
| Mineralogische Salzbezeichnung | Thenardit |
| Chemische Bezeichnung | Natriumsulfat |
| Trivialname | Phase V, Makit, Menardit, Pyrotechnit |
| Chemische Formel | Na2SO4 |
| Hydratformen | Mirabilit (Na2SO4•10H2O) Natriumsulfat-Heptahydrat (Na2SO4•7H2O) |
| Kristallsystem | orthorhombisch |
| Deliqueszenzfeuchte 20°C | 86,6 % |
| Löslichkeit(g/l) bei 20°C | 3,706 mol/kg |
| Dichte (g/cm³) | 2,689 g/cm³ |
| Molares Volumen | 53,11 cm3/mol |
| Molare Masse | 142,04 g/mol |
| Transparenz | durchsichtig |
| Spaltbarkeit | vollkommen |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | löslich in Wasser und Glycerin, in wasserfreiem Ethanol unlöslich |
| Kristalloptik | |
| Brechungsindices | nx = 1,471 ny = 1,477 nz = 1,484 |
| Doppelbrechung | Δ = 0,013 |
| Optische Orientierung | positiv |
| Pleochroismus | |
| Dispersion | 82,5° |
| Verwendete Literatur | |
| [Robie.etal:1978]Titel: Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures Autor / Verfasser: Robie R.A., Hemingway B.S.; Fisher J.A.  [Dana:1951]Titel: Dana's System of Mineralogy [Dana:1951]Titel: Dana's System of MineralogyAutor / Verfasser: Dana J.D. 
| |
Natriumsulfat und Thenardit[Bearbeiten]
Abstract[Bearbeiten]
Thenardit als wasserfreie Phase des Natriumsulfats und seine Eigenschaften sollen vorgestellt werden.
Vorkommen[Bearbeiten]
Sowohl Thenardit wie auch Mirabilit erscheinen als natürliche Mineralien. In Mineralwässern, als Ablagerungen ehemaliger Salzseen und in Form unterschiedlicher Doppelsalze tritt Natriumsulfat in der Natur auf. Die Kenntnis des kristallwasserhaltigen Natriumsulfates reicht nachweislich bis in das 16. Jh. zurück. Erste Beschreibungen desselben sind von Glauber aus dem Jahre 1658 überliefert, welcher es als “sal mirable” bezeichnete. Auf dessen Namen zurückgehend ist auch die Trivialbezeichnung “Glaubersalz” für Mirabilit in der Literatur anzutreffen.
Angaben zu Herkunft und Bildung von Thenardit/Mirabilit an Baudenkmalen[Bearbeiten]
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumsulfat als Ausblühsalz entstehen, wenn mit schwefeligen Gasen kontaminierte Luft einwirkt oder sonstige Sulfatquellen vorliegen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch können 100 kg Portlandzement mit einem Gehalt von lediglich 0,1% löslichem Na2O in schwefelsäurehaltiger Luft 520g Mirabilit ausbilden [Angaben nach Arnold/Zehnder 1991]. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendeten Restaurierungsprodukten (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächenwasser anzuführen, die Na+-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem Natriumchlorid. In Küstennähe ist NaCl-haltiges Meerwasser als Natriumquelle zu berücksichtigen.
Lösungsverhalten[Bearbeiten]
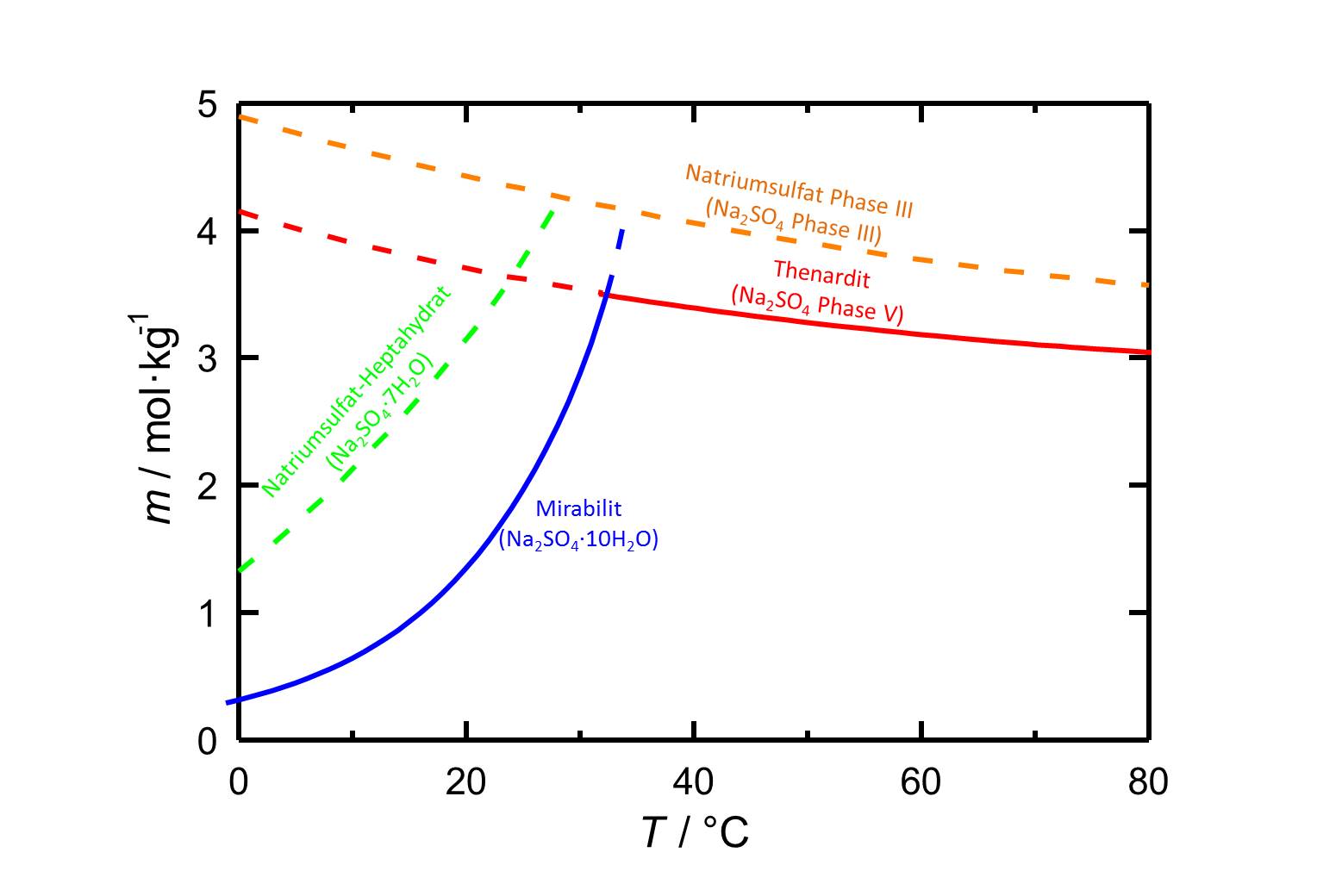
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke
 .
.
Thenardit ist unterhalb von 32,4 °C metastabil. Mit einer Löslichkeit von 3,7 mol/kg bei 20°C gehört es zu den leichtlöslichen Salzen und somit auch zu den leicht mobilisierbaren Salzen (vgl.Tabelle Hygroskopizität der Salze und Gleichgewichtsfeuchte). Die Löslichkeit von Thenardit weist wie auch die der anderen Phasen im System Na2SO4-H2O eine Temperaturabhängigkeit auf. Mit dem starken Einfluß der Temperatur auf die Löslichkeit von Thenardit ist die Gefahr einer Lösungsübersättigung bezüglich Mirabilit bei raschem Temperaturabfall und Kristallisation von Mirabilit verbunden.
Siehe hierzu auch Natriumsulfat.
Hygroskopizität[Bearbeiten]
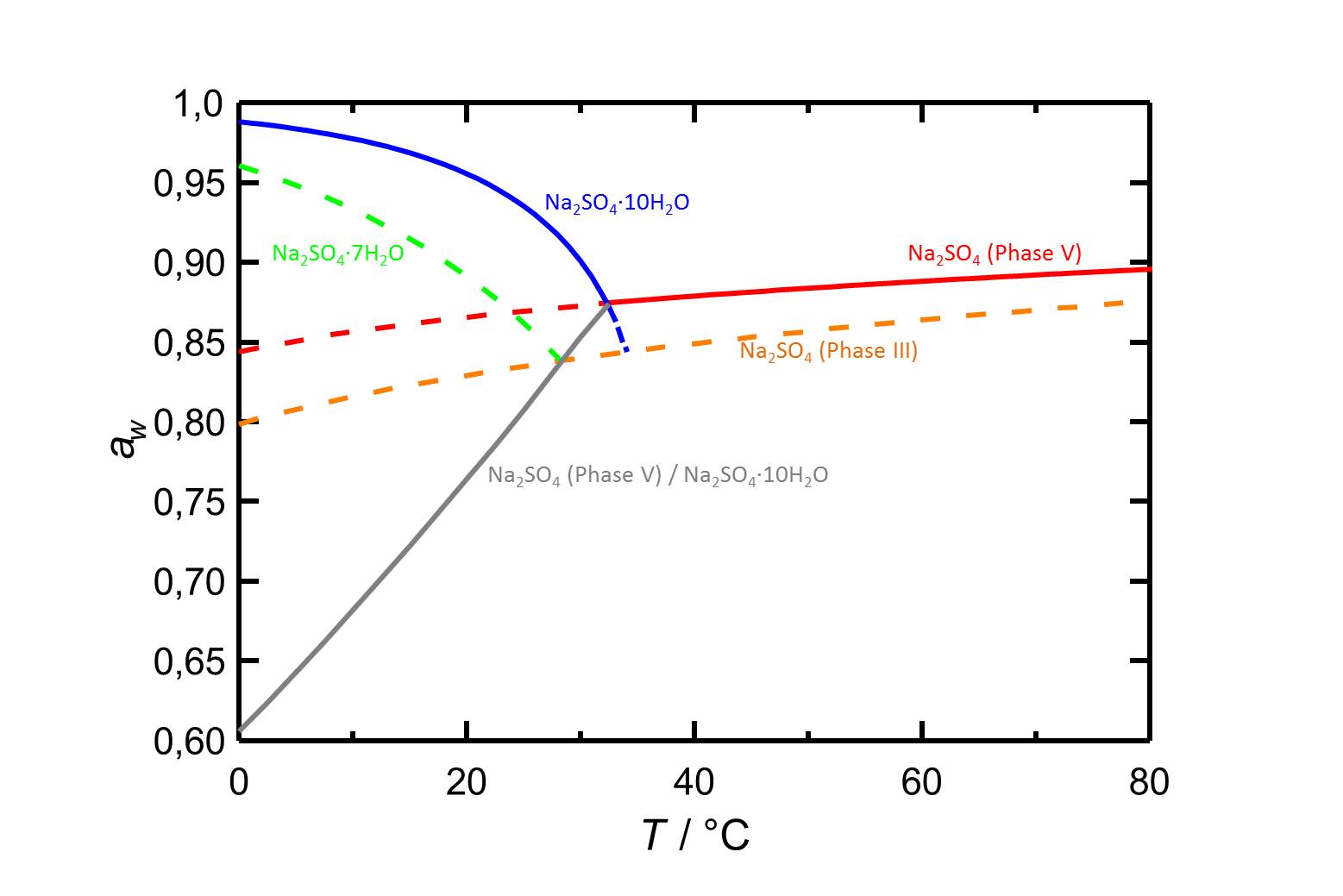
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke

In Abbildung 2 ist der Temperatureinfluß auf die Deliqueszenzfeuchten von Thenardit sowie der anderen Phasen des Natriusulfats verdeutlicht. Auffällig sind hierbei die gegenläufigen Kurvenverläufe der Deliqueszenz von Thenardit und Mirabilit. Siehe hierzu auch Natriumsulfat.
Die Deliqueszenzfeuchte von Thenardit verschiebt sich bei steigender Temperatur zu höheren Werten (s. Tabelle 1).
| 0°C | 10°C | 20°C | 30°C | 40°C | 50°C |
| 84,4%r.F. | 85,6%r.F. | 86,6%r.F. | 87,3%r.F. | 87,9%r.F. | 88,4%r.F. |
In Anwesenheit von Fremdionen (bei Salzgemischen) verändern sich die Parameter der Gleichgewichtsfeuchte und der notwendigen Temperatur- und Feuchtebedingungen für Umkristallisationen zudem deutlich. Als orientierende Daten sind in der unteren Tabelle experimentell erfaßte Werte der Gleichgewichtsfeuchte in unterschiedlichen Salzgemischen wiedergegeben. Es zeigt sich, daß alle Werte der Gleichgewichtsfeuchte unter denen des Reinsalzes Mirabilit liegen (vgl. Tabelle Gleichgewichtsfeuchte in Abhängigkeit von Temperatur).
| MgSO4 | Ca(NO3)2 | KNO3 | |
| Na2SO4 • 10H2O | 87(21°C) | 74 (21°C) | 81(21°C) |
Feuchtesorption:
Als weitere Angabe zur Abschätzung der Hygroskopizität von Thenardit sind in der nachstehenden Tabelle Werte für das Sorptionsverhalten des Reinsalzes und des Gemisches mit Halit bei unterschiedlichen relativen Feuchten wiedergegeben:
| Lagerungsfeuchte | 87% r.F. | 81% r.F. | 79% r.F. |
| Na2SO4 | 79 | 0 | 0 |
| Na2SO4+NaCl (1:1 molare Mischung) | 157 | 32 | 15 |
Kristallisationsdruck[Bearbeiten]
Bei der Kristallisation aus wäßriger Lösung läßt sich für Thenardit ein Kristallisationsdruck von 29,2-34,5 N/mm2 angeben. Im Vergleich mit den berechneten Angaben der Kristallisationsdrücke anderer bauschädlichen Salze kann Thenardit einen hohen Kristallisationsdruck aufbauen [Winkler:1975]Titel: Stone: Properties, Durability in Man ´s Environment
Autor / Verfasser: Winkler, Erhard M. .
.
Hydratationsverhalten[Bearbeiten]
Das System Na2SO4 – H2O:
Als nachweisbare, stabile Hydratstufen existieren lediglich das Anhydrit (Thenardit) und das Dekahydrat (Mirabilit). Die Erzeugung von Mirabilit kann durch Rekristallisation des Salzes aus übersättigter, wäßriger Lösung bei einer Temperatur von unter 32,4°C erfolgen. Insbesondere aufgrund der Hydratstufenbildung, der mit einem Einbau von 10 Wassermolekülen in das Kristallgitter und einer Volumenexpansion von rund 320% verbunden ist und der niedrigen Übergangstemperatur von ca. 32-35°C zählen Natriumsulfate zu den sehr verwitterungsaktiven Schadsalzen. Auch dieser Wert ist als Richtwert zu verstehen. Der Phasenübergang Mirabilit – Thenardit kann bei einer Temperatur von 25 °C bei einer relativen Feuchte von ca. 80% stattfinden, beträgt die Umgebungstemperatur 0°C, so ist ein Übergang bereits bei einer r.F. von 60,7% möglich [Angaben nach Gmelin]. Es zeigt sich also auch hier ein starker Temperatureinfluß. Eine Abschätzung der Schadensaktivität durch Kristallisations- und Hydratationsprozesse der Natriumsulfate wird sich an einem Bauwerk bei varierenden Einflußgrößen also sehr schwierig darstellen, da die Klimaparameter das Verhalten extrem beeinflussen.
Hydratationsdruck[Bearbeiten]
Der Hydratationsdruck, der beim Übergang von Thenardit zu Mirabilit aufgebaut wird, ist stark abhängig von den bestehenden Luftfeuchte- und Temperaturverhältnissen, was in der nachstehenden Tabelle verdeutlicht ist:
| rel. Feuchte % | 20,0 °C | 25,0 °C | 30,0 °C |
| 100 | 48,9 N/mm2 | 40,5 N/mm2 | 28,9 N/mm2 |
| 95,0 | 41,3 N/mm2 | 32,7 N/mm2 | 23,3 N/mm2 |
| 90,0 | 33,5 N/mm2 | 24,9 N/mm2 | 13,7 N/mm2 |
| 85,0 | 25,5 N/mm2 | 16,0 N/mm2 | 5,1 N/mm2 |
| 80,0 | 16,4 N/mm2 | 7,8 N/mm2 | 0,0 |
| 75,0 | 6,7 N/mm2 | 0,0 | - |
Die Volumenveränderung, die beim Phasenübergang stattfindet, ist mit ca. 320% anzugeben [Sperling.etal:1980]Titel: Salt Weathering on Arid Environment, I. Theoretical ConsiderationsII. Laboratory Studies
Autor / Verfasser: Sperling, C.H.B.and Cooke, R.U. .
.
Analytischer Nachweis[Bearbeiten]
Mikroskopie
[Bearbeiten]
Laboruntersuchung:
Durch mikroskopische Beobachtungen des Lösungsverhaltens sind die gute Wasserlöslichkeit und Ethanolunlöslichkeit zu verifizieren. Thenardit und Mirabilit besitzen keine morphologische Charakterisitka, die bei einfachen Rekristallisationsversuchen zur Identifizierung beitragen können. Vielmehr ist eine große Bandbreite unterschiedlichster Erscheinungsformen beobachtbar.
Brechungsindizes: nx = 1,468; ny =1,473; nz =1,483
Doppelbrechung: Δ = 0.015
Kristallklasse: orthorhombisch
Polarisationsmikroskopische Untersuchung:
In Abhängigkeit von den vorliegenden Luftfeuchte- und Temperaturbedingungen verändern Kristalle des Rohprobematerials und des rekristallisierten Präparates ihren Kristallwassergehalt. An trockner Luft (mit r.F. < 80% und Raumtemperatur) verliert Mirabilit sein Kristallwasser und geht in Thenardit über. Dieser Vorgang kann mikroskopisch klar nachvollzogen werden, wenn der Prozess der Rekristallisation beobachtet wird. Mirabilit weist charakteristische anormale Interferenzfarbe auf, im Zuge des Wasserverlustes und Entstehen von Thenardit schwächen sich die anormalen Interferenzphänomene zunehmend ab.
Die Zuweisung der Brechungsindizes von Thenardit erfolgt entsprechend der Immersionsmethode. Aufgrund der niedrigen maximalen Doppelbrechung zeigt Thenardit zumeist graue Interferenzfarben. Die Auslöschung ist parallel oder symmetrisch.
Verwechslungsmöglichkeiten:
Generell ist die Unterscheidung einer bestimmten Anzahl von Sulfaten (die unten aufgelistet sind und wozu Thenardit zählt) ohne mikrochemische Bestimmung der Anionen problematisch, da die Brechungsindizes der Salze dicht beieinander liegen und alle Salze eine niedrige Doppelbrechung aufweisen. Hilfreich ist die Verwendung eines Immersionsmittels mit einem nD-Wert von 1,48. Eine Differenzierung innerhalb dieser Gruppe wird damit möglich. Außerdem können die unten genannten Eigenschaften als Abgrenzungskriterien hinzugezogen werden.
Eindeutig bestimmbar wird Thenardit durch die Möglichkeit, nach Auflösung des Probematerials im Zuge der Rekristallisation das Phänomen anormaler Interferezfarben beobachten zu können, sprich Mirabilit in der hohen Hydratstufe zu identifizieren und somit indirekt Thenardit nachzuweisen.
| Salzphase | Unterscheidungsmerkmal |
| Boussingaultit (NH4)2Mg(SO)4 • 6H20 | keine anormalen Interferenzfarben / schiefe Auslöschung |
| Pikromerit K2Mg(SO4)2 • 6H20 | keine anormalen Interferenzfarben / schiefe Auslöschung |
| Bloedit Na2Mg(SO4)2 • 6H20 | alle Indizes >1,48 / keine anormalen Interferenzfarben / schiefe Auslöschung / optisch negativ orientiert. |
| Glaserit K3Na(SO4)2 | alle Indizes >1,48 / keine anormalen Interferenzfarben/schiefe Auslöschung |
| Arcanit K2SO4 | alle Indizes >1,48 / keine anormalen Interferenzfarben |
| Magnesiumformiat Mg(HCO2)2 • 2H2O | vergleichsweise hohe Doppelbrechung / keine anormalen Interfernzfarben / schiefe Auslöschung |
Betrachtung von Mischsystemen:
Mischsystem Na+– Ca2+– SO4 2-: Der Ausfall von Gips erfolgt im Zuge der Rekristallisation entsprechend der geringeren Löslichkeit desselben zuerst. Der charakteristische nadelige Habitus von einzelnen Gipskristallen wie auch von Aggregaten bleibt bestehen. Der Ausfall von Natriumsulfat erfolgt später, das eigentliche Kristallwachstum vollzieht sich merklich schneller. Die Morphologie ist unspezifisch.
Mischsystem Na+– SO4 2-– Cl-: Der Ausfall der beiden Partikelsorten beginnt etwa zeitgleich. Halit mit charakteristischer Morphologie, Natriumsulfat in extrem variierender Gestalt.
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
- Thenardit Ausblühungen an Objekten
Weblinks
[Bearbeiten]
- ↑ http://webmineral.com/data/Thenardite.shtml gesehen 29.07.2010
- ↑ http://www.mindat.org/min-3935.html gesehen 29.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Thenardit gesehen 29.07.2010
Literatur[Bearbeiten]
| [Dana:1951] | Dana E.S. (Hrsg.) Dana J.D. (1951): Dana's System of Mineralogy, 7, Wiley & Sons |  |
| [Robie.etal:1978] | Robie R.A., Hemingway B.S.; Fisher J.A. (1978): Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures. In: U.S. Geol. Surv. Bull, 1452 () |  |
| [Sperling.etal:1980] | Sperling, C.H.B.and Cooke, R.U. (1980): Salt Weathering on Arid Environment, I. Theoretical ConsiderationsII. Laboratory Studies. In: Papers in Geography, 8 () |  |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Webadresse, https://doi.org/10.1016/j.gca.2008.05.053 |  |
| [Vogt.etal:1993] | Vogt, R.; Goretzki, Lothar (1993): Der Einfluss hygroskopischer Salze auf die Gleichgewichtsfeuchte und Trocknung anorganischer Baustoffe, unveröffentlichter Bericht. |  |
| [Winkler.etal:1970] | Winkler, Erhard M.; Wilhelm, E.J. (1970): Saltburst by Hydration Pressure in Architectural Stone in Urban Atmosphere. In: Geological Society of America, Bulletin, 81 (), 567-572 |  |
| [Winkler:1975] | Winkler, Erhard M. (1975): Stone: Properties, Durability in Man ´s Environment, Springer Verlag, Wien |  |
Weitere Literatur
| [Amirthalingam.etal:1977] | Amirthalingam V., Karkhanavala M. D., Rao U. R. K. (1977): Topotaxic phase change in Na2SO4. In: Acta Crystallographica Section A, 33 (3), 522-523, https://doi.org/10.1107/S0567739477001296 |  |
| [Amirthalingam:1977] | Amirthalingam, V.; Karkhanaavala, M. D.; Rao, U. R. K. (1977): Topotaxic phase change in Na2SO4. In: Acta Cryst., A33 (), 522-523 |  |
| [Bayh.etal:1966] | Bayh, W.; Haussuehl, Siegfried (1966): Elastische und mechanische Eigenschaften von Na2SO4 (Thenardit). In: Acta Crystallogr, 20 (6), 931-932 |  |
| [Bednarska.etal:2022] | Bednarska, D.; Koniorczyk, M.; Steiger, M. (2022): Identification of various salt crystallization and water freezing patterns induced by temperature variation from Na2SO4 – H2O system confined in porous materials. In: Construction and Building Materials, 347 (), Webadresse, https://doi.org/10.1016/j.conbuildmat.2022.128540 |  |
| [Brown.etal:2000] | Brown, P. W.; Badger, S. (2000): The distributions of bound sulfates and chlorides in concrete subjected to mixed NaCl, MgSO4, Na2SO4 attack. In: Cem. Concr. Res., 30 (10), 1535-1542 |  |
| [Brown.etal:2001] | Brown, P. W.; Badger, S. (2001): Reply to the discussion by William G. Hime and Stella L. Marusin of the paper "The distribution of bound sulfates and chlorides in concrete to mixed NaCl, MgSO4, Na2SO4 attack". In: Cem. Concr. Res., 31 (7), 1117-1118 |  |
| [CHEN.etal:2024] | Dong-Mei Chen; Kun Yuan; Xian-Ming Zhang (2024): Morphology transformation of Na2SO4 from prism into dendrite enhanced desalination efficiency in sandstone by biodegradable polycarboxylate modifiers. In: Construction and Building Materials, 411 (), 134513, Webadresse, https://doi.org/10.1016/j.conbuildmat.2023.134513 |  |
| [DeClercq.etal:2012] | Clercq, Hilde; Jovanović, Maja; Linnow, Kirsten; Steiger, Michael (2012): Performance of limestones laden with mixed salt solutions of Na2SO4–NaNO3 and Na2SO4–K2SO4. In: Environmental Earth Sciences, (), 1-11, Webadresse, 10.1007/s12665-012-2017-0 |  |
| [Donkers.etal:2015] | Donkers, P.; Linnow, K.; Pel, L.; Steiger, M.; Adan,O. (2015): Na2SO4·10H2O dehydration in view of thermal storage. In: Chemical Engineering Science, 134 (), 360-366, Webadresse, https://doi.org/10.1016/j.ces.2015.05.028 |  |
| [Freyer.etal:1997] | Freyer, D.; Fischer, St.; Koehnke, K.and Voigt W. (1997): Formation of double salt hydrates: I Hydration of quenched Na2SO4-CaSO4 phases. In: Solid State Ionics, 96 (2), 29-33, 10.1016/S0167-2738(96)00612-1, |  |
| [Friedel:1978] | Friedel, B. (1978): Gipslöslichkeiten in wässerigen Systemen mit NaCl, MgCl2, Na2SO4 und MgSO4. In: Zeitschrift für Pflanzenernährung und Bodenkunde, 141 (3), 337-346, 10.1002/jpln.19781410309 |  |
| [Granneman.etal:2019] | Granneman, S.J.C.; Lubelli, B.; van Hees, R.P.J. (2019): Effect of mixed in crystallization modifiers on the resistance of lime mortar against NaCl and Na2SO4 crystallization. In: Construction and Building Materials , 194 (), 62-70, Webadresse |  |
| [Lindstroem.etal:2014] | Lindström, N.; Talreja, T.; Linnow, K.; Steiger, M. (2014): Crystallization behavior of a Na2SO4–MgSO4 salt mixture and comparison to single salt behavior. In: Hilde De Clercq (Hrsg.): Proceedings of SWBSS 2014 3rd International Conference on Salt Weathering of Buildings and Stone Sculptures,KIK-IRPA, Royal Institute for Cultural Heritage Brussels 151-165, 10.5165/hawk-hhg/258. |   |
| [Lindstroem.etal:2015] | Nadine Lindström; Nicole Heitmann; Kirsten Linnow; Michael Steiger (2015): Crystallization behavior of NaNO3–Na2SO4 salt mixtures in sandstone and comparison to single salt behavior. In: Applied Geochemistry, 63 (), 116 - 132, Webadresse, https://doi.org/10.1016/j.apgeochem.2015.07.007 |  |
| [Lindstroen.etal:2016] | Nadine Lindström; Tanya Talreja; Kirsten Linnow; Amelie Stahlbuhk; Michael Steiger (2016): Crystallization behavior of Na2SO4–MgSO4 salt mixtures in sandstone and comparison to single salt behavior. In: Applied Geochemistry, 69 (), 50 - 70, Webadresse, https://doi.org/10.1016/j.apgeochem.2016.04.005 |  |
| [Linnow.etal:2012] | Linnow, Kirsten; Steiger, Michael; Lemster, Christine; Clercq, Hilde; Jovanović, Maja (2012): In situ Raman observation of the crystallization in NaNO3–Na2SO4–H2O solution droplets. In: Environmental Earth Sciences, (), 1-12, Webadresse, 10.1007/s12665-012-1997-0 |  |
| [Marliacy.etal:2000] | Marliacy, P.; Solimando, R.; Bouroukba, M.; Schuffenecker, L. (2000): Thermodynamics of crystallization of sodium sulfate decahydrate in H2O-NaCl-Na2SO4: application to Na2SO4.cntdot.10H2O-based latent heat storage materials. In: Thermochim. Acta, 344 (1), 85-94 |  |
| [Moffadel.etal:1991] | Moffadel, N.; Bouzaziz, R.; Mayer, M. (1991): Le polymorphisme du sulfate de sodum anhydre et les phases intermédiaries, glasérite et aphtitalite, dans le binaire Na2SO4-K2SO4. In: Thermochimica Acta, 185 (1), 141-153, 10.1016/0040-6031(91)80125-3 |  |
| [Naruse.etal:1987] | Naruse, H.; Tanaka, K.; Morikawa, H.; Marumo, F. (1987): Structure of Na2SO4(I) at 693 K. In: Acta Crystallographica, B43 (), 143-146 |  |
| [Nord:1973] | Nord, Anders G. (1973): Refinement of the Crystal Structure of Thenardite, Na2SO4(V). In: Acta Chem. Scand., 27 (3), 814-822 |  |
| [Platford:1975] | Platford, R. F. (1975): Thermodynamics of the system H2O-NaCl-MgCl2-Na2SO4-MgSO4 at 25 degrees C. In: Mar. Chem., 3 (4), 261-270 |  |
| [Potter.etal:1978] | Potter, R. W. I.; Clynne, M. A. (1978): Solubility of high soluble salts in aqueous media; Part 1, NaCl, KCl, CaCl2, Na2SO4, and K2SO4 solubilities to 100 degrees C. In: Journal of Research of the U. S. Geological Survey, 6 (6), 701-705 |  |
| [Ptacek.etal:1992] | Ptacek, C. J.; Reardon, E. J. (1992): Solubility of siderite (FeCO3) in concentrated NaCl and Na2SO4 solutions at 25 degrees C. In: Kharaka, Yousif K.; Maest, Ann S. (Hrsg.): Proceedings of the 7th international symposium on water-rock interaction, 181-184. |  |
| [Rard:1979] | Rard, J. A.; Miller, D. G. (1979): The mutual diffusion coefficients of Na2SO4-H2O and MgSO4-H2O at 25 degrees C from Rayleigh interferometry. In: J. Solut. Chem., 8 (10), 755-756 |  |
| [Rasmussen.etal:1996] | Rasmussen, Svend Erik; Jorgensen, Jens-Erik; Lundoft, Britta (1996): Structure and phase transition of Na2SO4. In: Journal of Applied Crystallography, 29 (), 42-47, 10.1107/S0021889895008818 |  |
| [Sarada.etal:1990] | Sarada, S.; Ananthaswamy, J. (1990): Thermodynamic Properties of Electrolyte Solutions: Emf Study of the System NaCl-Na2SO4-H20 at 25, 35 and 45 ÄC. In: Journal Chem. Soc. Faraday Trans., 86 (1), 81-84 |  |
| [Shen.etal:2020] | Shen, Y.; Linnow, K.; Steiger, M. (2020): Crystallization Behavior and Damage Potential of Na2SO4-NaCl Mixtures in Porous Building Materials. In: Crystal Growth & Design, 20 (9), 5974-5985, https://doi.org/10.1021/acs.cgd.0c00671 |  |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Webadresse, https://doi.org/10.1016/j.gca.2008.05.053 |  |
| [Tishchenko.etal:1992] | Tishchenko, Pavel Ya.; Bychkov, Alexander S.; Hravéczy-Páll, Andrea; Tóth, Klára; Pungor, Ernoe (1992): Activity Coefficients for the System NaCl + Na2SO4 + H2O at Various Temperatures. Application of Pitzer's Equations. In: Journal of Solution Chemistry, 21 (3), 261-274 |  |
| [Xu.etal:1999] | Xu B., Schweiger G. (1999): In-situ Raman observations of phase transformation of Na2SO4 during the hydration/dehydration cycles on single levitated microparticle.. In: J. Aerosol. Sci., (), 379-380, Webadresse, https://doi.org/10.1016/S0021-8502(99)80201-8 |  |
| [Zdanovskii.etal:1991] | Zdanovskii, A. B.; Frolovskii, E. E. (1991): Equations for calculating the solubility of mirabilite in the aqueoussodium chloride-magnesium sulfate (2NaCl + MgSO4 = Na2SO4 + MgCl2) system at 0-25.degree. In: Zh. Prikl. Khim. (Leningrad), 64 (6), 1153-7 |  |
